
(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式:__________________________;
负极的电极反应式:__________________________。
(3)下图是一个电解过程示意图。
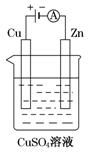
①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
【知识点】本题考查各种分类方式相关知识
【答案】(1)N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624 kJ·mol-1 (2分)
(2)O2+2H2O+4e-=4OH- (2分)
N2H4+4OH--4e-=4H2O+N2↑ (2分)
(3)①Cu2++2e-=Cu (1分) ②112 (2分)
解析(1))1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量,32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应,在碱性环境下的反应式为:N2H4+4OH--4e-=4H2O+N2↑,正极上是氧气发生得电子的还原反应,在碱性环境下,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;N2H4+4OH--4e-=4H2O+N2↑;(3)①电解池的负极上是阳离子铜离子发生得电子的还原反应,即Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;②铜片上的电极反应为:Cu-2e-=Cu,Cu的质量变化128g,根据电极反应,转移电子为4mol,根据反应N2H4+O2=N2+2H2O,当转移电子4mol时,消耗氧气的物质的量是1mol,氧气的体积是空气体积的五分之一,所以消耗空气的体积是5mol,即112L,故答案为:112;
【思路点拨】本题是一道有关热化学和电化学知识的综合考察知识题目,要求学生具有分析和解决问题的能力,难度中等


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
把M mol H2和N mol C2H4混合, 在一定条件下使它们一部分发生反应生成W mol C2H6, 将
反应后所得的混合气体完全燃烧, 消耗氧气的物质的量为 ( )
A.M + 3N mol B.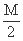 + 3N mol[
+ 3N mol[
C.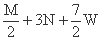 mol D.
mol D.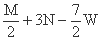 mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,错误的是( )
A.苯酚具有弱酸性,但不能使紫色石蕊变红
B.能因发生化学反应而使溴水褪色的物质一定是和溴水发生加成反应
C.用核磁共振氢谱鉴别1溴丙烷和2溴丙烷
D.含醛基的有机物都能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1kJ·mol-1;
HCl(aq)与NaOH(aq)反应的ΔH=-55.6kJ·mol-1。
则HCN在水溶液中电离的ΔH等于( )
A.+43.5kJ·mol-1 B.-43.5kJ·mol-1 C.+67.7kJ·mol-1 D.-67.7kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法正确的是( )

A.图a中,插入海水中的铁棒越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.原子核内有10个中子的氧原子:18O B.乙烯的结构简式: CH2CH2

 C.CH4 分子的比例模型: D.-CH3(甲基)的电子式为:
C.CH4 分子的比例模型: D.-CH3(甲基)的电子式为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com