
【题目】根据在元素周期表中位置靠近的元素具有相似的性质这一规律,可利用元素周期表寻找新材料。下列说法不正确的是
A. 在金属元素和非金属元素的交界处寻找半导体材料
B. 在过渡元素中寻找耐高温材料
C. 在过渡元素中寻找优良的催化剂
D. 在金属元素区域寻找新型农药材料
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】某同学要以“研究苯分子的结构”为题目做一次探究活动,下面是其活动记录,请你补全所缺内容。
(1)理论推测:他根据苯的凯库勒式________,推测苯分子中有两种不同的碳碳键,即________和________,因此它能使紫色的________溶液褪色。
(2)实验验证:他取少量的上述溶液加入试管中,然后加入苯,充分振荡,发现_____________________。
(3)实验结论:上述的理论推测是________(填“正确”或“错误”)的。
(4)查询资料:经查阅有关资料,发现苯分子中六个碳原子之间的键________(填“相同”或“不同”),是一种特殊的键,苯分子中的六个碳原子和六个氢原子________(填“在”或“不在”)同一个平面上,应该用________表示苯分子的结构更合理。
(5)发现问题:当他将苯加入溴水中时,充分振荡,发现能使溴水褪色,于是该同学认为所查资料有误。你同意他的结论吗?____。为什么?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m g由铜与镁组成的混合物加入含n mol HNO3的稀硝酸中,两者恰好完全反应,生成V1 mL标准状况下的NO气体(假定还原产物只有NO),再向所得溶液中加入V2 mL 6 mol·L-1 NaOH溶液,溶液中金属离子恰好完全沉淀,测得生成(m+10.2)g沉淀。下列相关判定一定不正确的是( )
A. m=19.2B. n=0.8
C. V1=4.48D. V2=200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,部分性质及转化关系如下图:

请回答:
(1)D中官能团的名称是_____________。
(2)A→B的反应类型是________________。
A.取代反应B.加成反应 C.氧化反应 D.还原反应
(3)写出A→C反应的化学方程式_______________________。
(4)某烃X与B是同系物,分子中碳与氢的质量比为36:7,化学性质与甲烷相似。现取两支试管,分别加入适量溴水,实验操作及现象如下:
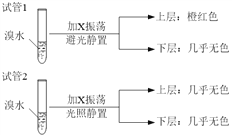
有关X的说法正确的是_______________________。
A.相同条件下,X的密度比水小
B.X的同分异构体共有6种
C.X能与Br2发生加成反应使溴水褪色
D.试验后试管2中的有机层是上层还是下层,可通过加水确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同温同压下H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的ΔH都相同
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为-241.8kJ/mol
C. 在稀溶液中H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 molH2SO4的浓硫酸与含1 molNaOH的稀溶液混合,放出的热量为57.3 kJ
D. 由N2O4(g) ![]() 2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹,下列与实验事实相符的是
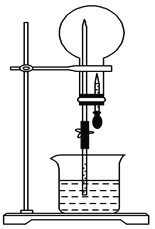
A. NH3(H2O含紫色石蕊试液),红色喷泉
B. SO2(NaOH溶液),无色喷泉
C. HCl(H2O含紫色石蕊试液),蓝色喷泉
D. NO(NaOH溶液),无色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
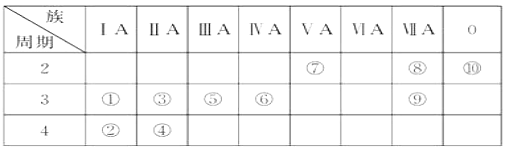
(1)①~⑩中,最活泼的金属元素是________(写元素符号,下同),最不活泼的元素是________。
(2)①⑧的简单离子,其半径更大的是________(写离子符号)。
(3)⑧⑨的气态氢化物,更稳定的是____________(填化学式)。
(4)元素的非金属性:⑥________⑦(填“>”或“<”)。
(5)①~⑨的最高价氧化物的水化物中:酸性最强的是____________(填化学式);碱性最强的是__________(填化学式),该碱与⑤的最高价氧化物的水化物反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_________g。
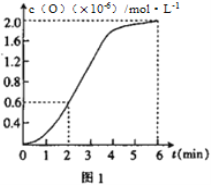
(2)已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2的平均反应速率 υ(CO2)=_________。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2的平均反应速率 υ(CO2)=_________。
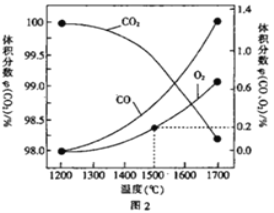
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2 所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2 所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有_________ (填字母)。
A.CO 的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO 的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=_________(计算结果保留1 位小数)。
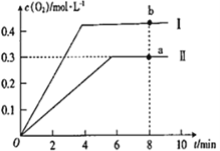
③向恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是________;a、 b两点用CO浓度变化表示的净反应速率关系为υa(CO)_________(填“>”“<”或“=”) υb( CO)。
2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是________;a、 b两点用CO浓度变化表示的净反应速率关系为υa(CO)_________(填“>”“<”或“=”) υb( CO)。
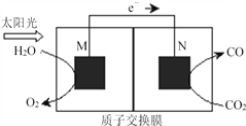
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为___________________________,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com