
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| … |
| 0.224L |
| 22.4L/mol |
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量反应后的溶液于试管中,滴加lmol?L-1的H2SO4至溶液呈酸性; | 若溶液出现浑浊,则假设1成立; 若溶液不出现浑浊,则假设2或3成立; |
| 步骤2:向步骤1所得溶液中滴入2滴淀粉-KI溶液 | 若溶液变蓝色,则假设2成立; 若溶液不变蓝色,结合步骤1的结论,则假设3成立; |
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量反应后的溶液于试管中,滴加lmol?L-1的H2SO4至溶液呈酸性; | 若溶液出现浑浊,则假设1成立; 若溶液不出现浑浊,则假设2或3成立; |
| 步骤2:向步骤1所得溶液中滴入2滴淀粉-KI溶液 | 若溶液变蓝色,则假设2成立; 若溶液不变蓝色,结合步骤1的结论,则假设3成立; |


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
| ||
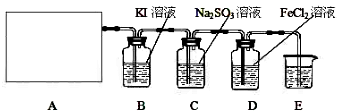
查看答案和解析>>
科目:高中化学 来源: 题型:
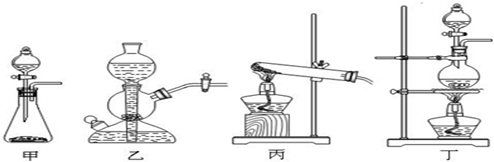
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
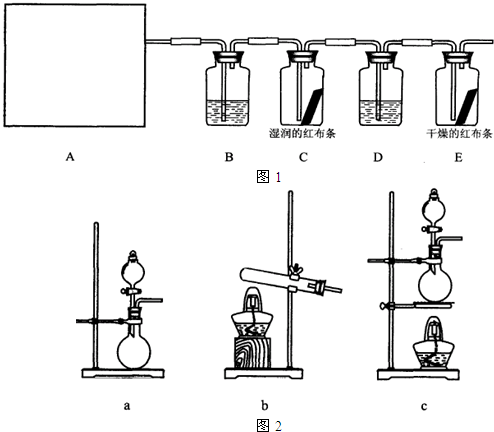
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
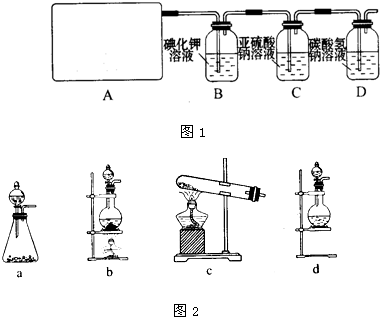
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com