
【题目】物质A~F有如图所示的转化关系,各反应均在高温下进行(必要时需催化剂),A是一种常见的金属单质,B常温下是一种液态化合物,E为一种无色气体,且E分子的电子数与N2的电子数相同。
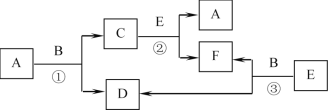
(1)写出①的化学方程式____。
(2)写出③的化学方程式____。
(3)写出一个B作还原剂的化学方程式____。
(4)写出一个F作氧化剂的化学方程式_____。
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2 CO+H2O(g)
Fe3O4+4H2 CO+H2O(g)![]() CO2+H2 2F2+2H2O=4HF+O2 C+CO2
CO2+H2 2F2+2H2O=4HF+O2 C+CO2![]() 2CO(或2Mg+CO2
2CO(或2Mg+CO2![]() 2MgO+C)
2MgO+C)
【解析】
反应均是在高温下进行的(必要时可使用催化剂),A是一种常见的金属单质,B常温下是一种液态化合物,E为一种无色气体,且E分子的电子数与N2的电子数相同,则E为CO,依据转化关系结合反应条件分析判断,A为Fe,B为H2O,C为Fe3O4,D为H2,E为CO,F为CO2,据此分析解答。
(1)反应①是铁和水蒸气反应生成四氧化三铁和氢气,化学方程式3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)反应③是一氧化碳和水蒸气反应生成二氧化碳和氢气,化学方程式CO+H2O(g)![]() CO2+H2;
CO2+H2;
(3)B为H2O,氟单质与水反应生成氟化氢和氧气,该反应中水作还原剂,化学方程式2F2+2H2O=4HF+O2;
(4)F为CO2,二氧化碳在高温下与碳单质反应生成一氧化碳,或二氧化碳与金属镁反应生成氧化镁和碳单质,反应中二氧化碳作氧化剂,化学方程式C+CO2![]() 2CO(或2Mg+CO2
2CO(或2Mg+CO2![]() 2MgO+C);
2MgO+C);


科目:高中化学 来源: 题型:
【题目】某学生做浓硫酸性质的实验:
实验一:在一个白色的点滴板的孔穴中先分别加入小纸片、少量CuSO4·5H2O;然后再分别滴入几滴浓硫酸,观察现象。回答下列问题:
(1)浓硫酸滴入小纸片上,小纸片变__(填实验现象),说明浓硫酸具有__性。
(2)浓硫酸滴入CuSO4·5H2O中,胆矾__(填实验现象),说明浓硫酸具有__性。
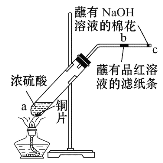
实验二:按如图所示装置进行实验。玻璃管中放的是蘸有品红溶液的滤纸,玻璃管口处缠放蘸有NaOH溶液的棉花。给试管加热,观察现象,一段时间以后,停止加热。
回答下列问题:
(3)写出a处反应的化学方程式:__。
(4)试管中的液体反应一段时间后,b处滤纸条的变化为__。
(5)写出C处NaOH的作__。有关的化学反应方程式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质间纷繁复杂的转化关系是化学的魅力所在,下列选项中物质的转化在一定条件下不能一步实现的是( )
A.Si![]() SiO2
SiO2![]() SiB.NO2
SiB.NO2![]() HNO3
HNO3![]() NO2
NO2
C.Fe![]() FeCl3
FeCl3![]() FeD.S
FeD.S![]() SO2
SO2![]() S
S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如右图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )

A. 1∶1∶3B. 1∶2∶4C. 1∶1∶4D. 1∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
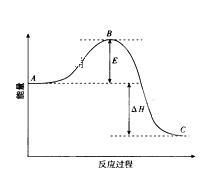
(1)该反应通常用V2O5作催化剂加快反应的进行,加V2O5会使图中B点______(填“升高”或“降低”)。
(2)E的大小对该反应的反应热有无影响_______。
(3)图中A表示SO2(g)和O2(g)的_________。
(4)图中△H的意义是__________。
(5)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化过程实际发生反应的化学方程式_____,_____;
(6)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中硫、氮的氧化物是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等。某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成三份,进行如下实验:
试样 | 所加试剂 | 实验现象 |
第一份试液 | 滴加适量的淀粉KI溶液 | 溶液呈蓝色 |
第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀产生 |
第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体的物质的量(n)的关系如图 |
|
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是____,不能确定的离子有___。
(2)写出第一份试液滴加淀粉KI溶液时发生反应的离子方程式:____。
(3)第三份试液滴加NaOH溶液,加热,整个过程中发生了多个反应,写出其中两个反应的离子方程式:
①最初发生的离子反应____。
②最后发生的离子反应____。
(4)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种酸式盐AHB,它的水溶液显弱碱性,今有下列说法,其中正确的是
A.相同温度相同浓度的AOH溶液和H2B溶液,电离程度前者大于后者
B.HB—的电离程度大于HB—的水解程度
C.该盐的电离方程式为AHB=A++H++B2—
D.在溶液中离子浓度大小顺序一般为:c(A+)>c(OH—)>c(HB—)>c(B2—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,回答下列问题:

(1)该注射液中葡萄糖的质量分数为___________;
(2)该注射液中葡萄糖的物质的量浓度为__________。(保留两位小数)
(3)检测人的血液中葡萄糖(简称血糖,相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com