
【题目】物质间纷繁复杂的转化关系是化学的魅力所在,下列选项中物质的转化在一定条件下不能一步实现的是( )
A.Si![]() SiO2
SiO2![]() SiB.NO2
SiB.NO2![]() HNO3
HNO3![]() NO2
NO2
C.Fe![]() FeCl3
FeCl3![]() FeD.S
FeD.S![]() SO2
SO2![]() S
S
科目:高中化学 来源: 题型:
【题目】探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ. ![]()
![]()
Ⅱ. ![]()
![]()
Ⅲ. ![]()
![]()
回答下列问题:
(1)![]() _________
_________![]() 。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为__________mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
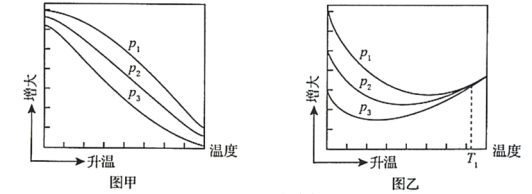
已知:CO2的平衡转化率=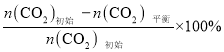
CH3OH的平衡产率=![]()
其中纵坐标表示CO2平衡转化率的是图___________(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________;图乙中T1温度时,三条曲线几乎交于一点的原因是___________。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________(填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天青石主要用于制造碳酸锶(SrCO3)以及生产电视机显像管玻璃等,其主要成分是SrSO4,还含有少量BaSO4。测定天青石中钡元素的含量可采用以下方法。
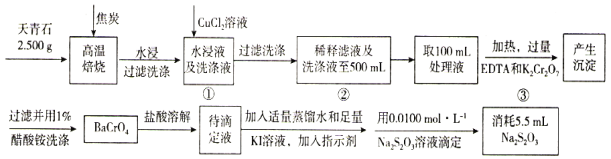
已知:①EDTA可与Sr2+、Cu2+形成配合物;
②BaCrO4在盐酸中溶解,产生Cr2O72-;
③2Na2S2O3+I2=Na2S4O6+2NaI;
④Ksp(CuS)=3.4×10-36。
(1)高温焙烧时SrSO4和BaSO4被过量的焦炭还原为可溶性的SrS和BaS,写出SrSO4与焦炭反应的化学反应方程式________,BaS的电子式为________。
(2)加入EDTA的目的是________________。
(3)过程③的离子反应方程式________________。
(4)若过程①和过程②未将洗涤液与滤液合并会导致测定Ba的含量________(填“偏大”“偏小”或“无影响”)。
(5)滴定时以________为指示剂,滴定终点观察到的现象________。
(6)加入CuCl2,目的是将溶液中的S2-沉淀完全,当溶液中c(Cu2+)为0.1mol/L时,溶液中c(S2-)的浓度为________。
(7)该天青石中钡的质量分数为________%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)写出R的原子结构示意图:___。
(2)五种元素原子半径由大到小的顺序是(写元素符号)__。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A![]() B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式___;①如果A、B均由三种元素组成,B为两性不溶物,则A
B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式___;①如果A、B均由三种元素组成,B为两性不溶物,则A![]() B离子反应方程式为___。
B离子反应方程式为___。
②A、B均为盐溶液,如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因___;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学各设计了一个实验,结果各自都认为自己的试样中含有SO42-离子。
甲的实验为:
![]()
(1)乙认为甲的实验不严谨,因为试样A中若含有________离子(仅填一种)也会有此现象。
乙的实验为:
![]()
(2)丙认为乙的实验也不严谨,因为试样B中若含有________离子(仅填一种)也会有此现象。
丙的实验为:
![]()
若丙方案合理,回答:
(3)若丙实验合理,则其中试剂Ⅰ是___________,现象Ⅰ是__________;试剂Ⅱ是___________,现象Ⅱ是__________。(若你认为丙方案不合理,以上四空可以不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ表示t0时升温对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~F有如图所示的转化关系,各反应均在高温下进行(必要时需催化剂),A是一种常见的金属单质,B常温下是一种液态化合物,E为一种无色气体,且E分子的电子数与N2的电子数相同。
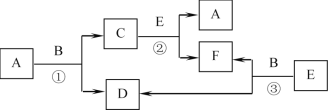
(1)写出①的化学方程式____。
(2)写出③的化学方程式____。
(3)写出一个B作还原剂的化学方程式____。
(4)写出一个F作氧化剂的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾属于欧盟批准使用的食品添加剂,受热易分解: 3K4[Fe(CN)6]![]() 12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
A.Fe2+的最高能层电子排布为 3d6
B.配合物K4[Fe(CN)6]中配位原子是碳原子
C.(CN)2分子中σ键和π键数目比为 3:4
D.已知 Fe3C 晶胞中每个碳原子被 6 个铁原子包围,则铁的配位数是 2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com