
【题目】探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ. ![]()
![]()
Ⅱ. ![]()
![]()
Ⅲ. ![]()
![]()
回答下列问题:
(1)![]() _________
_________![]() 。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为__________mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________。
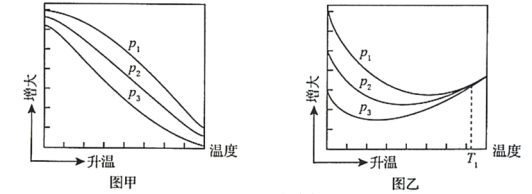
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=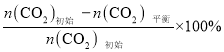
CH3OH的平衡产率=![]()
其中纵坐标表示CO2平衡转化率的是图___________(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________;图乙中T1温度时,三条曲线几乎交于一点的原因是___________。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________(填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
【答案】+40.9 ![]()
![]() 乙 p1、p2、p3 T1时以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响 A
乙 p1、p2、p3 T1时以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响 A
【解析】
根据盖斯定律计算反应热;利用三个反应,进行浓度和化学平衡常数的计算;结合图形根据勒夏特列原理考虑平衡移动的方向,确定温度和压强变化时,CO2的平衡转化率和CH3OH的平衡产率之间的关系得到相应的答案。
(1).根据反应I+II=III,则△H3=△H1+△H2=-49.5kJmol-1+(-90.4 kJmol-1)=+40.9 kJmol-1;
(2).假设反应II中,CO反应了xmol,则II生成的CH3OH为xmol,I生成的CH3OH为(a-x)mol,III生成CO为(b+x)mol,根据反应I: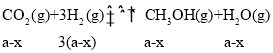 ,反应II:
,反应II:  ,反应III:
,反应III: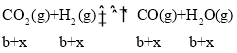 ,所以平衡时水的物质的量为(a-x)mol+(b+x)mol =(a+b)mol,浓度为:
,所以平衡时水的物质的量为(a-x)mol+(b+x)mol =(a+b)mol,浓度为:![]() ;平衡时CO2的物质的量为1mol-(a-x)mol-(b+x)mol=(1-a-b)mol,H2的物质的量为3mol-3(a-x)mol-2x-(b+x)mol=(3-3a-b)mol,CO的物质的量为bmol,水的物质的量为(a+b)mol,则反应III的平衡常数为:
;平衡时CO2的物质的量为1mol-(a-x)mol-(b+x)mol=(1-a-b)mol,H2的物质的量为3mol-3(a-x)mol-2x-(b+x)mol=(3-3a-b)mol,CO的物质的量为bmol,水的物质的量为(a+b)mol,则反应III的平衡常数为: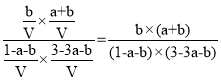 ;
;
(3).反应I和II为放热反应,升高温度,平衡逆向移动,则CH3OH的平衡产率减少,所以图甲表示CH3OH的平衡产率,图乙中,开始升高温度,由于反应I和II为放热反应,升高温度,平衡逆向移动,CO2的平衡转化率降低,反应III为吸热反应,升高温度反应III向正反应方向移动,升高一定温度后以反应III为主,CO2的平衡转化率又升高,所以图乙表示CO2的平衡转化率;压强增大,反应I和II是气体体积减小的反应,反应I和II平衡正向移动,反应III气体体积不变化,平衡不移动,故压强增大CH3OH的平衡产率增大,根据图所以压强关系为:p1>p2>p3;温度升高,反应I和II平衡逆向移动,反应III向正反应方向移动,所以T1温度时,三条曲线交与一点的原因为:T1时以反应III为主,反应III前后分子数相等,压强改变对平衡没有影响;
(4).根据图示可知,温度越低,CO2的平衡转化率越大,CH3OH的平衡产率越大,压强越大,CO2的平衡转化率越大,CH3OH的平衡产率越大,所以选择低温和高压,答案选A。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的有
①![]() 该原子的电子排布图,最外层违背了洪特规则
该原子的电子排布图,最外层违背了洪特规则
②处于最低能量状态原子叫基态原子,![]() 过程中形成的是发射光谱
过程中形成的是发射光谱
③运用价层电子对互斥理论,![]() 离子的空间构型为三角锥型
离子的空间构型为三角锥型
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3 中 N-Cl 键的键长比 CCl4 中 C-Cl 键的键长短
A.1 个B.2 个C.3 个D.4 个
查看答案和解析>>
科目:高中化学 来源: 题型:
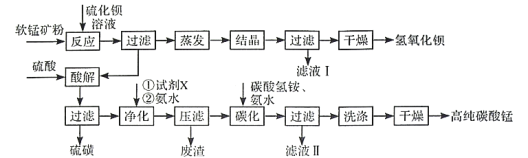
【题目】用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp |
|
|
|
|
回答下列问题
(1)软锰矿预先粉碎的目的是____________,MnO2与BaS溶液反应转化为MnO的化学方程式为________。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是________。
(3)滤液I可循环使用,应当将其导入到________操作中(填操作单元的名称)。
(4)净化时需先加入的试剂X为________(填化学式)。再使用氨水调溶液的pH,则pH的理论最小值为_______(当溶液中某离子浓度![]() 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分为MgCO3,含少量SiO2,Fe2O3和A12O3)为原料制备高纯镁砂的工艺流程如下:
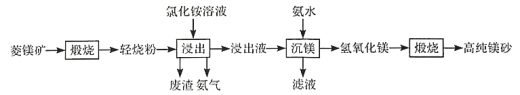
已知浸出时产生的废渣中有SO2,Fe(OH)3和Al(OH)3。下列说法错误的是
A.浸出镁的反应为![]()
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-氰基丙烯酸异丁酯可用作医用胶,其结构简式如下。下列关于α-氰基丙烯酸异丁酯的说法错误的是
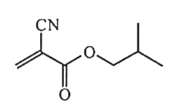
A.其分子式为 C8H11NO2
B.分子中的碳原子有3种杂化方式
C.分子中可能共平面的碳原子最多为6个
D.其任一含苯环的同分异构体中至少有4种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成吲哚-2-酮类药物的一种中间体,其合成路线如下:
![]() (
(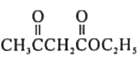 )
)![]()
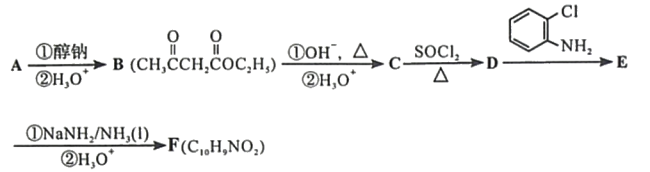
知:Ⅰ.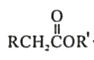
![]()
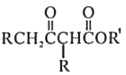
Ⅱ. 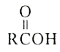
![]()
![]()
![]()
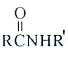
Ⅲ. 
![]()
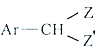
Ar为芳基;X=Cl,Br;Z或Z′=COR, CONHR,COOR等。
回答下列问题:
(1)实验室制备A的化学方程式为___________,提高A产率的方法是______________;A的某同分异构体只有一种化学环境的碳原子,其结构简式为_______________。
(2)C→D的反应类型为____________;E中含氧官能团的名称为____________。
(3)C的结构简式为____________,F的结构简式为____________。
(4)Br2和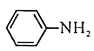 的反应与Br2和苯酚的反应类似,以
的反应与Br2和苯酚的反应类似,以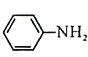 和
和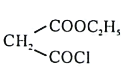 为原料合成
为原料合成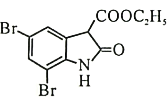 ,写出能获得更多目标产物的较优合成路线(其它试剂任选)________。
,写出能获得更多目标产物的较优合成路线(其它试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
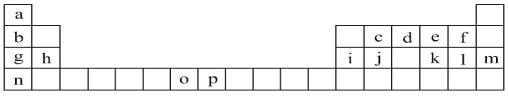
(1)元素d基态原子包含____种运动状态不同的电子,这些电子位于____种能量不同的原子轨道中。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____。
(3)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是_____。
(4)第3周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是____(填I图中的序号)。表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是_____(填元素名称)。

(5)a、d、l三种元素可形成一种离子化合物,其中的化学键类型除了离子键,还包括____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做浓硫酸性质的实验:
实验一:在一个白色的点滴板的孔穴中先分别加入小纸片、少量CuSO4·5H2O;然后再分别滴入几滴浓硫酸,观察现象。回答下列问题:
(1)浓硫酸滴入小纸片上,小纸片变__(填实验现象),说明浓硫酸具有__性。
(2)浓硫酸滴入CuSO4·5H2O中,胆矾__(填实验现象),说明浓硫酸具有__性。
实验二:按如图所示装置进行实验。玻璃管中放的是蘸有品红溶液的滤纸,玻璃管口处缠放蘸有NaOH溶液的棉花。给试管加热,观察现象,一段时间以后,停止加热。
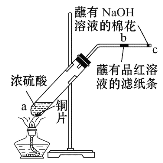
回答下列问题:
(3)写出a处反应的化学方程式:__。
(4)试管中的液体反应一段时间后,b处滤纸条的变化为__。
(5)写出C处NaOH的作__。有关的化学反应方程式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质间纷繁复杂的转化关系是化学的魅力所在,下列选项中物质的转化在一定条件下不能一步实现的是( )
A.Si![]() SiO2
SiO2![]() SiB.NO2
SiB.NO2![]() HNO3
HNO3![]() NO2
NO2
C.Fe![]() FeCl3
FeCl3![]() FeD.S
FeD.S![]() SO2
SO2![]() S
S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com