
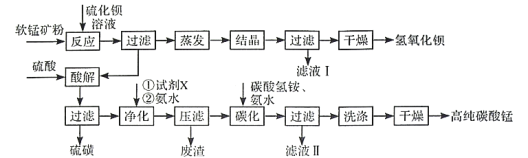
【题目】用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp |
|
|
|
|
回答下列问题
(1)软锰矿预先粉碎的目的是____________,MnO2与BaS溶液反应转化为MnO的化学方程式为________。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是________。
(3)滤液I可循环使用,应当将其导入到________操作中(填操作单元的名称)。
(4)净化时需先加入的试剂X为________(填化学式)。再使用氨水调溶液的pH,则pH的理论最小值为_______(当溶液中某离子浓度![]() 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为______________________。
【答案】增大接触面积,充分反应,提高反应速率: ![]() 过量的MnO2消耗了产生的Ba(OH)2 蒸发 H2O2 4.9
过量的MnO2消耗了产生的Ba(OH)2 蒸发 H2O2 4.9 ![]()
【解析】
软锰矿粉(主要成分为MnO2,含少量Fe3O4、Al2O3)加入硫化钡溶液进行反应,主要发生MnO2+BaS+H2O=Ba(OH)2+MnO+S,过滤得到Ba(OH)2溶液,经蒸发结晶、过滤、干燥得到氢氧化钡;滤渣用硫酸溶解,得到的滤液中主要金属阳离子有Mn2+、Fe2+、Fe3+、Al3+,得到的滤渣为不溶于稀硫酸的硫磺;之后向滤液中加入合适的氧化剂将Fe2+转化为Fe3+,然后加入氨水调节pH,使Fe3+、Al3+转化为沉淀除去,压滤得到的废渣为Fe(OH)3和Al(OH)3,此时滤液中的金属阳离子只有Mn2+,向滤液中加入碳酸氢铵、氨水,Mn2+和碳酸氢根电离出的碳酸根结合生成碳酸锰沉淀,过滤、洗涤、干燥得到高纯碳酸锰。
(1)软锰矿预先粉碎可以增大反应物的接触面积,使反应更充分,提高反应速率;MnO2与BaS反应转化为MnO,Mn元素的化合价由+4价降低为+2价,根据元素价态规律可知-2价的S元素应被氧化得到S单质,则MnO2与BaS的系数比应为1:1,根据后续流程可知产物还有Ba(OH)2,结合元素守恒可得化学方程式为:MnO2+BaS+H2O=Ba(OH)2+MnO+S;
(2)根据题目信息可知MnO2为两性氧化物,所以当MnO2过量时,会消耗反应产生的Ba(OH)2,从而使Ba(OH)2的量达到最大值或会减小;
(3)滤液I为结晶后剩余的Ba(OH)2饱和溶液,所以可以导入到蒸发操作中循环使用;
(4)净化时更好的除去Fe元素需要将Fe2+氧化为Fe3+,为了不引入新的杂质,且不将Mn元素氧化,加入的试剂X可以是H2O2;根据表格数据可知,Fe(OH)3和Al(OH)3为同种沉淀,而Al(OH)3的Ksp稍大,所以当Al3+完全沉淀时,Fe3+也一定完全沉淀,当c(Al3+)=1.0×10-5mol/L时,c(OHˉ)=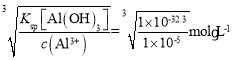 =10-9.1mol/L,所以c(H+)=10-4.9mol/L,pH=4.9,即pH的理论最小值为4.9;
=10-9.1mol/L,所以c(H+)=10-4.9mol/L,pH=4.9,即pH的理论最小值为4.9;
(5)碳化过程Mn2+和碳酸氢根电离出的碳酸根结合生成碳酸锰沉淀,促进碳酸氢根的电离,产生的氢离子和一水合氨反应生成铵根和水,所以离子方程式为Mn2++HCO![]() +NH3·H2O=MnCO3↓+NH
+NH3·H2O=MnCO3↓+NH![]() +H2O。
+H2O。


科目:高中化学 来源: 题型:
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
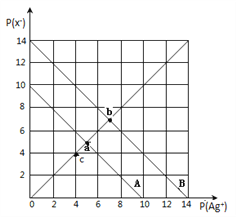
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是

A. M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(用元素符号或化学式回答下列问题)
(1)在这些元素中,化学性质最不活泼的是_______,其原子结构示意图是_________。
(2)用电子式表示元素④与⑦组成的化合物的形成过程:________,该化合物属于_______(填“共价”或“离子”)化合物。
(3)常温下呈液态的非金属单质是_______。
(4)表中能形成两性氢氧化物的元素是_________,该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式是___________。
(5)①、⑥、⑦三种元素的最高价氧化物对应的水化物中,按酸性增强的顺序排列为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )
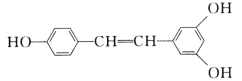
A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电子排布的表述正确的是( )
A.![]() 可表示单核8电子粒子基态时电子排布
可表示单核8电子粒子基态时电子排布
B.![]() 此图错误,违背了洪特规则
此图错误,违背了洪特规则
C.2p3表示基态氮原子的外围电子排布式
D.![]() 表示处于激发态的硼原子的电子排布图
表示处于激发态的硼原子的电子排布图
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是( )
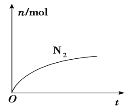
A.该反应的还原剂是Cl-
B.消耗1 mol还原剂,转移3 mol电子
C.氧化剂与还原剂的物质的量之比为2∶3
D.反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ. ![]()
![]()
Ⅱ. ![]()
![]()
Ⅲ. ![]()
![]()
回答下列问题:
(1)![]() _________
_________![]() 。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为__________mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
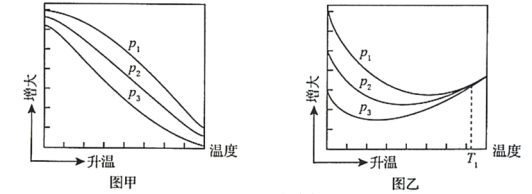
已知:CO2的平衡转化率=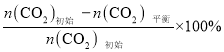
CH3OH的平衡产率=![]()
其中纵坐标表示CO2平衡转化率的是图___________(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________;图乙中T1温度时,三条曲线几乎交于一点的原因是___________。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________(填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天青石主要用于制造碳酸锶(SrCO3)以及生产电视机显像管玻璃等,其主要成分是SrSO4,还含有少量BaSO4。测定天青石中钡元素的含量可采用以下方法。
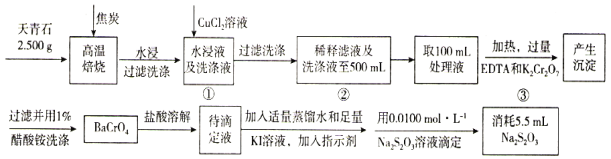
已知:①EDTA可与Sr2+、Cu2+形成配合物;
②BaCrO4在盐酸中溶解,产生Cr2O72-;
③2Na2S2O3+I2=Na2S4O6+2NaI;
④Ksp(CuS)=3.4×10-36。
(1)高温焙烧时SrSO4和BaSO4被过量的焦炭还原为可溶性的SrS和BaS,写出SrSO4与焦炭反应的化学反应方程式________,BaS的电子式为________。
(2)加入EDTA的目的是________________。
(3)过程③的离子反应方程式________________。
(4)若过程①和过程②未将洗涤液与滤液合并会导致测定Ba的含量________(填“偏大”“偏小”或“无影响”)。
(5)滴定时以________为指示剂,滴定终点观察到的现象________。
(6)加入CuCl2,目的是将溶液中的S2-沉淀完全,当溶液中c(Cu2+)为0.1mol/L时,溶液中c(S2-)的浓度为________。
(7)该天青石中钡的质量分数为________%(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com