
【题目】下列有关电子排布的表述正确的是( )
A.![]() 可表示单核8电子粒子基态时电子排布
可表示单核8电子粒子基态时电子排布
B.![]() 此图错误,违背了洪特规则
此图错误,违背了洪特规则
C.2p3表示基态氮原子的外围电子排布式
D.![]() 表示处于激发态的硼原子的电子排布图
表示处于激发态的硼原子的电子排布图
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是( )
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 共用三对电子形成双原子分子,常温下为气体单质 |
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用![]() 氨水滴定
氨水滴定![]() 浓度均为
浓度均为![]() 的
的![]() 和
和![]() 的混合液,下列说法不正确的是( )
的混合液,下列说法不正确的是( )
A. 在氨水滴定前,![]() 和
和![]() 的混合液中
的混合液中![]()
B. 当滴入氨水![]() 时,
时,![]()
C. 当滴入氨水![]() 时,
时,![]()
D. 当溶液呈中性时,氨水滴入量大于![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.32![]() 中含有的氧原子数是2×6.02×1023
中含有的氧原子数是2×6.02×1023
B.N2和CO共1mol的混合气体中含有的分子总数是2×6.02×1023
C.2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023
D.1.0 L 0.1 mol·L-1NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
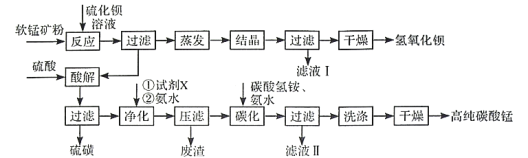
已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp |
|
|
|
|
回答下列问题
(1)软锰矿预先粉碎的目的是____________,MnO2与BaS溶液反应转化为MnO的化学方程式为________。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是________。
(3)滤液I可循环使用,应当将其导入到________操作中(填操作单元的名称)。
(4)净化时需先加入的试剂X为________(填化学式)。再使用氨水调溶液的pH,则pH的理论最小值为_______(当溶液中某离子浓度![]() 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从中草药中提取的 calebin A(结构简式如下)可用于治疗阿尔茨海默症。下列关于 calebin A的说法错误的是

A.可与FeCl3溶液发生显色反应
B.其酸性水解的产物均可与Na2CO3溶液反应
C.苯环上氢原子发生氯代时,一氯代物有6种
D.1mol该分子最多与8molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分为MgCO3,含少量SiO2,Fe2O3和A12O3)为原料制备高纯镁砂的工艺流程如下:
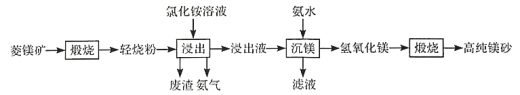
已知浸出时产生的废渣中有SO2,Fe(OH)3和Al(OH)3。下列说法错误的是
A.浸出镁的反应为![]()
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成吲哚-2-酮类药物的一种中间体,其合成路线如下:
![]() (
(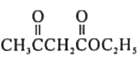 )
)![]()
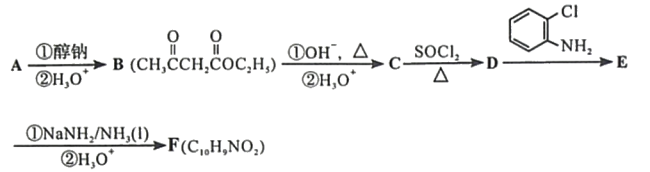
知:Ⅰ.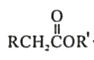
![]()
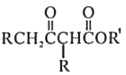
Ⅱ. 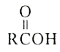
![]()
![]()
![]()
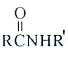
Ⅲ. 
![]()
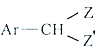
Ar为芳基;X=Cl,Br;Z或Z′=COR, CONHR,COOR等。
回答下列问题:
(1)实验室制备A的化学方程式为___________,提高A产率的方法是______________;A的某同分异构体只有一种化学环境的碳原子,其结构简式为_______________。
(2)C→D的反应类型为____________;E中含氧官能团的名称为____________。
(3)C的结构简式为____________,F的结构简式为____________。
(4)Br2和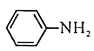 的反应与Br2和苯酚的反应类似,以
的反应与Br2和苯酚的反应类似,以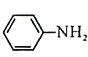 和
和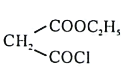 为原料合成
为原料合成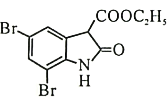 ,写出能获得更多目标产物的较优合成路线(其它试剂任选)________。
,写出能获得更多目标产物的较优合成路线(其它试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题:
(1)基态Co原子核外电子占据________种不同的能级,其中有________个未成对电子。
(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ键的数目为________。
②C、N、O三种基态原子的第一电离能由大到小的顺序为________(用元素符号表示)。
③在相同的压强下,CO晶体的熔点高于N2晶体的原因为_______________________。
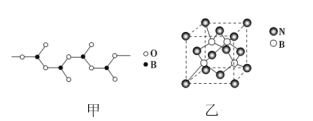
(3)BN晶体有多种结构,其中立方氮化硼具有金刚石型结构(如图乙)。
①晶体的最小环中含有________个B原子。
②若晶胞参数为anm,晶胞密度为ρg·cm-3,则阿伏加德罗常数的值可表示为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com