
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题:
(1)基态Co原子核外电子占据________种不同的能级,其中有________个未成对电子。
(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ键的数目为________。
②C、N、O三种基态原子的第一电离能由大到小的顺序为________(用元素符号表示)。
③在相同的压强下,CO晶体的熔点高于N2晶体的原因为_______________________。
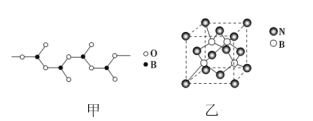
(3)BN晶体有多种结构,其中立方氮化硼具有金刚石型结构(如图乙)。
①晶体的最小环中含有________个B原子。
②若晶胞参数为anm,晶胞密度为ρg·cm-3,则阿伏加德罗常数的值可表示为________。
【答案】7 3 18NA(或18×6.02×1023等合理答案均可) N>O>C CO为极性分子,N2为非极性分子,CO分子间的范德华力更大 3 ![]()
【解析】
(1)基态Co原子核外电子排布式为1s22s22p63s23p63d74s2,原子核外电子占据1s、2s、2p、3s、3p、3d、4s,共7种不同的能级,其中有3个未成对电子。
故答案为:7;3 ;
(2)①1个CNO-中含有2个σ键,配位键也属于σ键,故1mol[Co(CNO)6]3-中含有σ键的数目为(2×6+6)×6.02×1023=18×6.02×1023;②等电子体是指价电子数和原子总数都相同的分子、离子或原子团,与CNO-互为等电子体的分子为CO2、CS2或N2O等;③同一周期元素从左到右第一电离能呈增大趋势,N原子中2p能级处于半充满稳定状态,第一电离能大于同周期相邻元素,C、N、O三种基态原子的第一电离能由大到小的顺序为N>O>C;④分子晶体熔点的高低取决于分子间作用力的大小,CO为极性分子而N2为非极性分子,故CO分子间作用力更大,即CO晶体的熔点高于N2晶体的熔点。
故答案为:18NA(或18×6.02×1023等合理答案均可); N>O>C; CO为极性分子,N2为非极性分子,CO分子间的范德华力更大;
(3)多硼酸根化学式为BO2-或(BO2)nn-,其中B原子形成3个σ键,杂化形式为sp2。
故答案为:3 ;
(4)①晶体的最小环中含有3个B原子和3个N原子,形成六元环。②立方氮化硼中,晶胞边长为anm,晶胞体积V=(anm)3,该晶胞中N原子个数=4、B原子个数为4,NA=![]() mol-1。
mol-1。
故答案为:![]() ;
;


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关电子排布的表述正确的是( )
A.![]() 可表示单核8电子粒子基态时电子排布
可表示单核8电子粒子基态时电子排布
B.![]() 此图错误,违背了洪特规则
此图错误,违背了洪特规则
C.2p3表示基态氮原子的外围电子排布式
D.![]() 表示处于激发态的硼原子的电子排布图
表示处于激发态的硼原子的电子排布图
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。
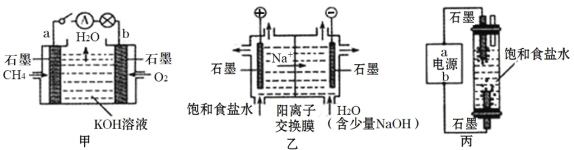
(1)甲装置中,a电极的反应式为_____。
(2)乙装置中,阴极区产物为_____。
(3)丙装置是一种家用84消毒液(NaClO)发生器。外接电源a为_____ (填“正”或“负”)极,该装置内发生反应的化学方程式为_____、_____。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为_____ (不考虑气体的溶解)。
(5)某工厂采用电解法处理含Cr2O72-的废水,耐酸电解槽用铁板作阴、阳极,槽内盛放含铬废水,Cr2O72-被还原成为Cr3+,Cr3在阴极区生成Cr(OH)3沉淀除去,工作原理如图。
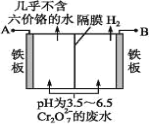
①写出电解时阴极的电极反应式____。
②写出Cr2O72-被还原为Cr3+的离子方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用太阳能光解水,制备的H2用于还原CO2合成有机物,可实现资源的再利用。回答下列问题:
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
(1)下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为___________。
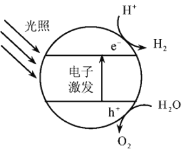
(2)若将该催化剂置于Na2SO3溶液中,产物之一为![]() ,另一产物为__________。若将该催化剂置于AgNO3溶液中,产物之一为O2,写出生成另一产物的离子反应式__________。
,另一产物为__________。若将该催化剂置于AgNO3溶液中,产物之一为O2,写出生成另一产物的离子反应式__________。
Ⅱ.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):![]()
(3)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a molL-1和3 a molL-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为___________。
(4)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
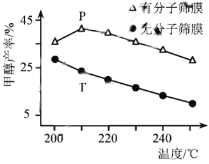
①甲醇平衡产率随温度升高而降低的原因为____________。
②P点甲醇产率高于T点的原因为___________。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为___________°C。
Ⅲ.调节溶液pH可实现工业废气CO2的捕获和释放
(5) ![]() 的空间构型为__________。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,
的空间构型为__________。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,![]() =1:_______:__________。
=1:_______:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天青石主要用于制造碳酸锶(SrCO3)以及生产电视机显像管玻璃等,其主要成分是SrSO4,还含有少量BaSO4。测定天青石中钡元素的含量可采用以下方法。
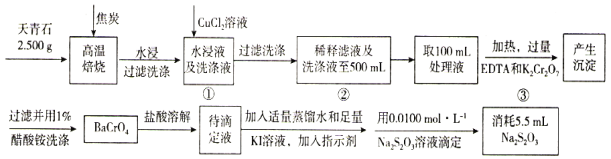
已知:①EDTA可与Sr2+、Cu2+形成配合物;
②BaCrO4在盐酸中溶解,产生Cr2O72-;
③2Na2S2O3+I2=Na2S4O6+2NaI;
④Ksp(CuS)=3.4×10-36。
(1)高温焙烧时SrSO4和BaSO4被过量的焦炭还原为可溶性的SrS和BaS,写出SrSO4与焦炭反应的化学反应方程式________,BaS的电子式为________。
(2)加入EDTA的目的是________________。
(3)过程③的离子反应方程式________________。
(4)若过程①和过程②未将洗涤液与滤液合并会导致测定Ba的含量________(填“偏大”“偏小”或“无影响”)。
(5)滴定时以________为指示剂,滴定终点观察到的现象________。
(6)加入CuCl2,目的是将溶液中的S2-沉淀完全,当溶液中c(Cu2+)为0.1mol/L时,溶液中c(S2-)的浓度为________。
(7)该天青石中钡的质量分数为________%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由以下粒子结构示意图得出的结论正确的是( )

A.④表示的是阳离子
B.①③属于同种元素,②④属于同种元素
C.②④形成的化合物是Al2O3
D.①③的化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)写出R的原子结构示意图:___。
(2)五种元素原子半径由大到小的顺序是(写元素符号)__。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A![]() B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式___;①如果A、B均由三种元素组成,B为两性不溶物,则A
B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式___;①如果A、B均由三种元素组成,B为两性不溶物,则A![]() B离子反应方程式为___。
B离子反应方程式为___。
②A、B均为盐溶液,如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因___;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ表示t0时升温对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若室温下0.1mol·L-1NaX溶液中pH=9,则该溶液中发生水解反应的X-占全部X-的( )
A.0.01%B.0.09%C.1.0%D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com