
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
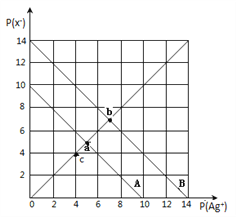
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
【答案】A
【解析】A. t℃时,c点在曲线下方,离子的浓度较大,是AgCl的过饱和溶液,A错误;B. 已知pAg=-lgc(Ag+),pX=-lgc(X-),银离子、氯离子浓度越大,浓度的负对数得到数值越小,氯化银溶解度大于溴化银,溶液中的离子浓度也是氯化银溶解度大于溴化银,所以A线表示的是AgCl,B线表示的是AgBr,B正确;C. 取a、b两点处溶液等体积混合,溶液体积增加,离子浓度减小,因此维持t℃不变,混合溶液中一定无白色沉淀生成,C正确;D. 根据图像可知银离子浓度相等时氯离子浓度是溴离子浓度的104倍,所以在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K=c(Cl-)/c(Br-)≈104,D正确,答案选A。
AgBr(s)+Cl-(aq)平衡常数K=c(Cl-)/c(Br-)≈104,D正确,答案选A。


科目:高中化学 来源: 题型:
【题目】Fe3O4是一种黑色粉末,又称磁性氧化铁,它的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
Ⅰ.提出假设: 假设1.黑色粉末是CuO;假设2.黑色粉末是Fe3O4;
假设3.黑色粉未是CuO和Fe3O4的混合物
Ⅱ.设计探究实验:
方案一:取少量粉末加入足量稀硝酸,若假设2或假设3成立则实验现象是___________,相关反应的离子方程式为__________________________________。
方案二: 查阅资料: Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若产生___________现象,则假设2成立;若产生___________现象,则假设3成立。
方案三:
学生丙利用下图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
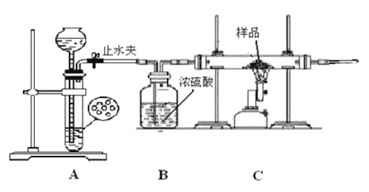
(1)下列实验步骤的先后顺序是___________(填序号)。
①打开止水夹;②关闭止水夹;③点燃C处的酒精喷灯;
④熄灭C处的酒精喷灯 ⑤收集氢气并验纯。
在点燃C处酒精喷灯前要进行的必要操作是__________________________。
(2)假设样品全部参加反应,若实验前样品的质量为4.7克,实验后称得装置C中固体的质量3.6克则假设___________(填“1”“2”或“3”) 正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图W、X、Y、Z为四种物质,若箭头是能一步转化的常见反应,其中常温下能进行的是( )
选项 | W | X | Y | Z |
|
A | S | SO2 | SO3 | H2SO4 | |
B | Al | AlCl3 | NaAlO2 | Al2(SO4)3 | |
C | Fe | FeCl3 | Fe(OH)2 | FeCl2 | |
D | Na | Na2O2 | NaOH | NaCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于双键上的氢原子很难发生取代反应,故2-氯-1,3- 丁二烯(![]() )不能通过1,3-丁二烯直接与氯气反应制得。2-氯-1,3-丁二烯的逆合成分析过程为:
)不能通过1,3-丁二烯直接与氯气反应制得。2-氯-1,3-丁二烯的逆合成分析过程为:
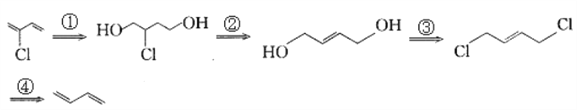
则有关说法正确的是
A. 上述逆合成过程中②、④的反应类型均为消去反应
B. 上述逆合成过程中,③的反应条件为NaOH的醇溶液、加热
C. 上述五种物质中只有一种物质所有原子不可能都在同一平面内
D. 上述逆合成途径中有2种物质有顺反异构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 用FeCl3溶液腐蚀铜线路板:Cu + Fe3+ = Cu2+ + Fe2+
B. 向氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O
C. Na2O2固体与H2O反应产生O2 :2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑
D. 向酸性KMnO4溶液中通入SO2:3SO2+2MnO+4OH-== 2MnO2↓+3SO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL 溶有0.1molCl2的氯水中滴加0.2mol/L 的NaOH 溶液,得到溶液pH 随所加NaOH溶液体积的变化图像如下。下列说法正确的是
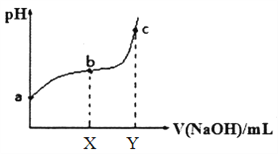
A. a 点有c(H+)=c(ClO-)+c(Cl-)
B. 若x=100,b 点对应溶液中:c(OH-)>c(H+),可用pH 试纸测定其pH
C. 若y=200,c 点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO)
D. b~c 段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1) 恒温恒容时,下列能说明合成氨反应达到平衡状态的是_________。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b. v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变
d.混和气体的密度保持不变
e.单位时间内断裂6molN-H键的同时,有3molH-H形成
f.混合气体的平均分子量不变
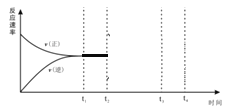
Ⅱ.(2)在恒温恒压密闭容器中充入1molN2和3molH2在t1时刻达到平衡状态后,t2时继续充入2mol NH3,t3时达到平衡,在下图中画出v(正)和v(逆) 在t2到t4间的变化曲线_________。
Ⅱ.由合成气(组成为H2、CO和少量的CO2) 直接制备二甲醚,涉及如下反应。
甲醇合成反应: _____
(ⅰ)时CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ·mol-1二甲醚合成反应
CH3OH(g) △H1=-90.1kJ·mol-1二甲醚合成反应
(ⅱ)2CH3OH(g)![]() CH3OCH(g)+H2O(g) △H2=-23.9 kJ·mol-1
CH3OCH(g)+H2O(g) △H2=-23.9 kJ·mol-1
(ⅲ)2CH3OH(g)![]() C2H4(g)+2H2O(g) △H3=-29.1kJ·mol-1
C2H4(g)+2H2O(g) △H3=-29.1kJ·mol-1
(1)二甲醚合成反应过程中两反应能量变化如图所示:
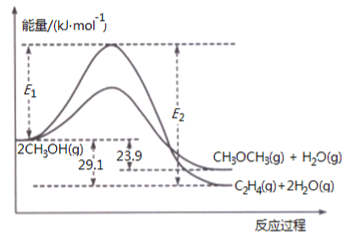
①反应速率较大的是__________(填序号“ⅱ”、“ⅲ”),说明原因________________。
②若在容器中加入催化剂,则E2-E1将__________(填“变大”、“ 不变”或“变小”)。
(2)Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数。一定温度时,向容器中充入2molH2和1molCO,反应(ⅰ) 达平衡状态时,总气体的物质的量为2mol,总压强为2×105pa,则KP___________为(需要带单位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)是火箭燃料,有专家设计了一种联氨环保电池,其工作原理如图所示。下列说法不正确的是
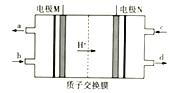
A. N极为电源的正极
B. M极生成氮气且电极附近PH升高
C. c口通入O2,电极反应式为O2+4e-+4H+=2H2O
D. 联氨的电子式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com