
【题目】Ⅰ.(1) 恒温恒容时,下列能说明合成氨反应达到平衡状态的是_________。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b. v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变
d.混和气体的密度保持不变
e.单位时间内断裂6molN-H键的同时,有3molH-H形成
f.混合气体的平均分子量不变
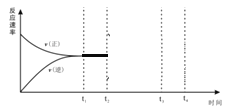
Ⅱ.(2)在恒温恒压密闭容器中充入1molN2和3molH2在t1时刻达到平衡状态后,t2时继续充入2mol NH3,t3时达到平衡,在下图中画出v(正)和v(逆) 在t2到t4间的变化曲线_________。
Ⅱ.由合成气(组成为H2、CO和少量的CO2) 直接制备二甲醚,涉及如下反应。
甲醇合成反应: _____
(ⅰ)时CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ·mol-1二甲醚合成反应
CH3OH(g) △H1=-90.1kJ·mol-1二甲醚合成反应
(ⅱ)2CH3OH(g)![]() CH3OCH(g)+H2O(g) △H2=-23.9 kJ·mol-1
CH3OCH(g)+H2O(g) △H2=-23.9 kJ·mol-1
(ⅲ)2CH3OH(g)![]() C2H4(g)+2H2O(g) △H3=-29.1kJ·mol-1
C2H4(g)+2H2O(g) △H3=-29.1kJ·mol-1
(1)二甲醚合成反应过程中两反应能量变化如图所示:
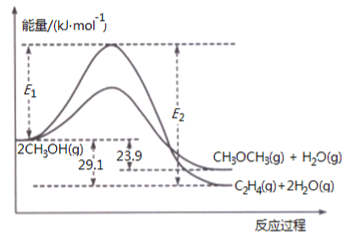
①反应速率较大的是__________(填序号“ⅱ”、“ⅲ”),说明原因________________。
②若在容器中加入催化剂,则E2-E1将__________(填“变大”、“ 不变”或“变小”)。
(2)Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数。一定温度时,向容器中充入2molH2和1molCO,反应(ⅰ) 达平衡状态时,总气体的物质的量为2mol,总压强为2×105pa,则KP___________为(需要带单位)
【答案】 c f  ⅱ 反应活化能低 不变 10-10pa-2
ⅱ 反应活化能低 不变 10-10pa-2
【解析】Ⅰ(1)a.容器内N2、H2、NH3浓度比与起始浓度及转化率有关,平衡时不一定等于化学计量数之比,故a错误;b.平衡时不同物质表示的正逆速率之比等于化学计量数之比,应是3v(N2)正=v(H2)逆时反应到达平衡状态,故b错误;c.随反应进行,混合气体物质的量变化,容器内压强发生变化,压强保持不变说明到达平衡,故c正确;d.混合气体总质量不变,容器容积不变,混合气体密度始终保持不变,故d错误;e.断裂6molN-H键的同时,有3molH-H形成都是正反应方向,故e错误;f.混合气体总质量不变,随反应进行,混合气体物质的量变化,则平均摩尔质量变化,若混合气体平均摩尔质量保持不变,说明到达平衡,故f正确,故选:cf;
(2)容器为恒温恒压密闭容器,当充入2mol NH3时,生成物的浓度增大,反应物的浓度减小,所以v(正)变小,v(逆)增大,故图像为
Ⅱ(1)①活化能越小,反应速率越大。所以反应速率较大的反应是ii。②催化剂可以降低反应所需的活化能,所以最高点下降,但是起终点不变,E2-E1表示的是焓变的负值,△H不变。
(2)
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
1 2 0
x 2x x
1-x 2-2x x
1-x+2+2x+x=2mol 解得x= 0.5mol
根据分压=总压×物质的量分数,得出KP=p(CH3OH)/p(CO)p2(H2)= 10-10pa-2


科目:高中化学 来源: 题型:
【题目】由于镁合金具有硬度大、密度小、散热性好、抗震性好等优异性能它被用于制笔记本电脑外壳、竞赛自行车车架等。现称取一定质量的镁铝合金样品放入500 mL稀硫酸中,固体全部溶解并放出气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。

(1)合金中Al的质量为__________________。
(2)NaOH溶液的物质的量浓度为__________________。
(3)稀硫酸的物质的量浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
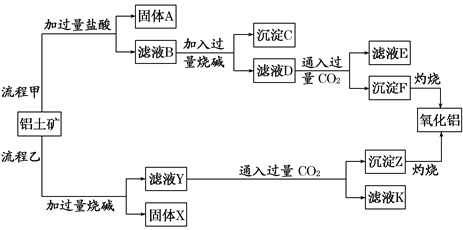
(1)写出流程甲加入盐酸后生成Al3+的离子方程式:___________________________。
(2)写出流程乙加入烧碱后生成SiO![]() 的离子方程式:___________________________。
的离子方程式:___________________________。
(3)为了验证滤液B中含Fe3+,可取少量滤液并加入___________(填试剂名称)。
(4)滤液E 、K中溶质的主要成分是_____(填化学式),写出该溶液的一种用途:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
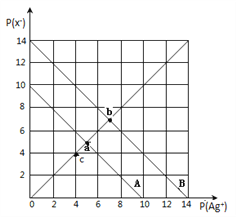
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铁的化合物在工业生产和日常生活中都有广泛的用途。请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:________________________________。
铁锈的主要成分是____________(填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:_____________________。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
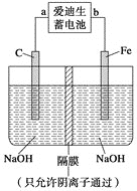
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是__________。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式__________________________。
③你认为高铁酸钠作为一种新型净水剂的理由可能是______。
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含002molCO2和001molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加______g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=______kJ/mol。
CO2(g)+O(g)的△H=______kJ/mol。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2) ·c(O),则此时v(正)_____(填“>""<"或"=”)v(逆)。
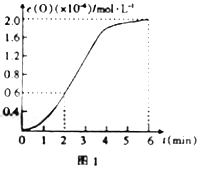
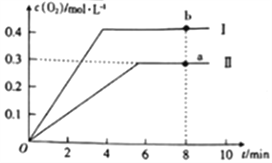
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
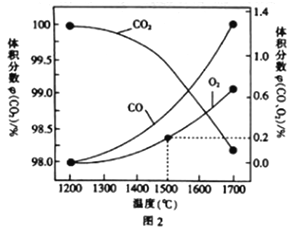
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母).
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=____(计算结果保留1位小数)。
③向2L的恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温、常压下,取下列四种气态烃各1 mol,分别在足量的氧气中燃烧,消耗氧气最多的是( )
A.CH4B.C3H8C.C4H10D.C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
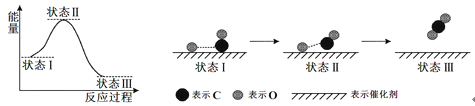
下列说法正确的是
A. 在该过程中,CO断键形成C和O B. 状态Ⅰ→状态Ⅲ表示CO与O2反应过程
C. CO和O生成CO2是吸热反应 D. CO和O生成了具有极性共价键的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2 (含有较多的MnO 和MnCO3) 样品转化为纯MnO2的实验,其流程如下:

(1)第①步加稀H2SO4时,粗MnO2样品中的________(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式:___________________________________。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、______、______、______,己知蒸发得到的固体中有NaClO3 和NaOH,则一定还有含有________(写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2 (标准状况下),则在第②步反应中至少需要___molNaClO3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com