
����Ŀ������þ�Ͻ����Ӳ�ȴ��ܶ�С��ɢ���Ժá������Ժõ������������������ƱʼDZ�������ǡ��������г����ܵȡ��ֳ�ȡһ��������þ���Ͻ���Ʒ����500 mLϡ�����У�����ȫ���ܽⲢ�ų����塣����Ӧ��ȫ����������Һ�м���NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ�������ϵ����ͼ��ʾ��

(1)�Ͻ���Al������Ϊ__________________��
(2)NaOH��Һ�����ʵ���Ũ��Ϊ__________________��
(3)ϡ��������ʵ���Ũ��Ϊ__________________��
���𰸡�5.4g 4.0 mol/L 0.8 mol/L
��������
��1������ͼ���֪��0��25 mL��������кͣ�25��200 mL��������������ɳ����ķ�Ӧ��200��240mL����Al(OH)3+NaOH=NaAlO2+2H2O��200 mLʱ���ɳ�����࣬��Һ�е�����Ϊ�����ƣ���ͼ���֪��������þ�����ʵ���Ϊ0.15 mol���ܽ���������������ʵ���Ϊ��0.35 mol-0.15 mol=0.2 mol��������ԭ���غ�ɵ�Al��������
��2�����ݷ�ӦAl(OH)3+NaOH=NaAlO2+2H2O������������Ƶ����ʵ���Ũ�ȣ�
��3����Һ��������Ϊ�����ƣ�����Ԫ���غ��֪��n(H2SO4) = n(SO42-) = n(Na+)/2 = n(NaOH)/2���ݴ˷�������
��1��þ���Ͻ���Ʒ����500 mLϡ�����У�����ȫ���ܽ�����þ���ӡ������ӣ������Һ�м���NaOH��Һ�������ɳ���ͼ�������֪���������������0-25 mLʱû�г������ɣ�˵��ԭ��Һ�д��������Ӽ����������200-250 mL�γ���������ʧ�������ķ�Ӧ�ǣ�Al(OH)3+OH-=AlO2-+2H2O������Ԫ���غ�ã�n(Al) = n[Al(OH)3] = (0.35-0.15) mol = 0.2 mol��m(Al)= 0.2mol ��27g/mol = 5.4 g��
�ʴ𰸣�5.4 g��
��2��n(Al) = n[Al(OH)3] = n(OH-) = n(NaOH) = (250-200) mL��10-3��c(NaOH) = 0.2mol��c(NaOH)= 4.0 mol/L��
��3����200 mLʱ��������������þ����������������Ϊ�����ƣ���ʱV(NaOH)=200 mL��n(NaOH)=0.2 L��4.0 mol/L=0.8 mol����n(H2SO4) = n(SO42-) = n(Na+)/2= n(NaOH)/2 = 0.4 mol��c(H2SO4)= 0.4 mol/0.5 L=0.8 mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:25 C ʱ,Ksp[Zn(OH)2]= 1.0��10-18�� Ka(HCOOH)= 1.0��10-4�����¶��£�����˵���������
A. HCOO����ˮ��ƽ�ⳣ��Ϊ 1.0��10-10
B. �� Zn(OH)2 ����Һ�м����� HCOOH,��Һ�� c(Zn2+)����
C. Zn(OH)2����ˮ�γɵı�����Һ��,c(Zn2��)>1.0��10-6 mol/L
D. Zn(OH)2(s) +2HCOOH(aq)![]() Zn2+(aq) +2HCOO��(aq) +2H2O(l)��ƽ�ⳣ�� K= 100
Zn2+(aq) +2HCOO��(aq) +2H2O(l)��ƽ�ⳣ�� K= 100
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������SO2(g)��O2(g)�ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ��2SO2(g)+ O2(g)![]() 2SO3 ��H<0���õ�����е���������������˵������ȷ����
2SO3 ��H<0���õ�����е���������������˵������ȷ����
ʵ���� | �¶�/�� | ƽ�ⳣ��/mol-1��L | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. T1��T2�Ĺ�ϵ��T1 �� T2
B. x= 1.6��y=0.2 ��t<6
C. K1��K2�Ĺ�ϵ��K2��K1
D. ʵ��1��ǰ6min�ķ�Ӧ������(SO2)=0.2 mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe3O4��һ�ֺ�ɫ��ĩ���ֳƴ�����������������ɿ�д��FeO��Fe2O3��ij��ѧʵ��С��ͨ��ʵ����̽��һ��ɫ��ĩ�Ƿ���Fe3O4��CuO���(������������ɫ����)��̽���������£�
��������裺 ����1����ɫ��ĩ��CuO������2����ɫ��ĩ��Fe3O4;
����3����ɫ��δ��CuO��Fe3O4�Ļ����
�����̽��ʵ�飺
����һ��ȡ������ĩ��������ϡ���ᣬ������2�����3������ʵ��������___________����ط�Ӧ�����ӷ���ʽΪ__________________________________��
�������� �������ϣ� Cu2+��������ˮ��Ӧ��������ɫ��Һ��Cu2++4NH3��H2O=Cu(NH3)42++4H2O��Ϊ̽���Ǽ���2���Ǽ���3��������ȡ������ĩ��ϡ�������ܽ���ټ���������ˮ��������___________���������2������������___________���������3������
��������
ѧ����������ͼ��ʾװ�ý���ʵ�飬������Ӧǰ��װ��C����Ʒ����������ȷ����Ʒ����ɡ��ش��������⣺
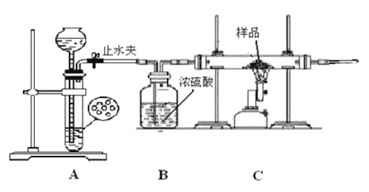
(1)����ʵ�鲽����Ⱥ�˳����___________(�����)��
�ٴ�ֹˮ�У��ڹر�ֹˮ�У��۵�ȼC���ľƾ���ƣ�
��Ϩ��C���ľƾ���� ���ռ��������鴿��
�ڵ�ȼC���ƾ����ǰҪ���еı�Ҫ������__________________________��
(2)������Ʒȫ���μӷ�Ӧ����ʵ��ǰ��Ʒ������Ϊ4.7�ˣ�ʵ���Ƶ�װ��C�й��������3.6�������___________(�1����2����3��) ��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I���������а�������: ���� ������ ��SiO2 ��H2SO4 ��NaOH ��FeSO4��Һ ��Ba(OH)2 ��������������
(1)�����������ڵ���ʵ���____________(�����)���ܵ������__________ (�����)��
(2)����м���ٵķ�ĩ����Ӧ�����ӷ���ʽΪ_____________________��
(3)����������������������ˮ��Һ�з�Ӧ�����ӷ���ʽΪH++OH-=H2O����÷�Ӧ�Ļ�ѧ����ʽΪ__________________________��
(4)ʵ�����Ʊ�������ӷ���ʽΪ:__________________�����ڢ��л�������ܵ���Һ��������������________________________��
(5) ���Dz�������Ҫ�ɷ�֮һ���������Һ��Ӧ�Ļ�ѧ����ʽΪ____________________������ʦ����_______(����������)����̲�����
II�����и������ʵķ�����ᴿ��Ӧѡ��������������һ��?(��ѡ����ĸ)
A.��Һ B.���� C.��ȡ D.���� E.�����ᾧ F.���·ֽ�
(1)����CCl4��H2O:___________��
(2)��ȥ����ʯ��ˮ��������CaCO3: ___________��
(3)����CCl4(�е�Ϊ76.75��)�ͼױ�(�е�Ϊ110.6��)��Һ������:__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
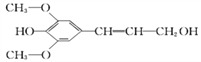
����Ŀ����1��ij�л���X��C��H��O����Ԫ����ɣ����ⶨ����Է�������Ϊ90��ȡ1.8gX�ڴ�������ȫȼ�գ��������Ⱥ�ͨ��Ũ����ͼ�ʯ�ң����߷ֱ�����1.08g��2.64g�����л���X�ķ���ʽΪ___________����֪�л���X����һ��-COOH���ں˴Ź��������Ϲ۲���ԭ�������������壬ǿ��Ϊ3��1��1��l ����X �Ľṹ��ʽΪ_______________��
��2����X������ͬ�����ŵķ����廯����Y������ʽΪC7H6O3 ��1molY�ֱ���������Na��NaOH��Һ��NaHCO3��Һ��Ӧ������Na��NaOH��NaHCO3�����ʵ���֮��Ϊ________��
��3��˫��A(Ҳ��BPA)�����������������Ͼ�̼������BPA�Ľṹ��ʽ��ͼ��ʾ��
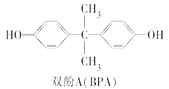
˫��A��һ�ֺϳ�·����ͼ��ʾ��
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
A��B�Ļ�ѧ����ʽ��_________________________________________��
��4����ʳ��ά����ͻ���ı������ܣ���Ϊ����ġ�����Ӫ���ء���ľ������һ�ַ�������ʳ��ά���䵥��֮һ�ǽ��Ӵ����ṹ��ʽ��ͼ��ʾ�������йؽ��Ӵ���˵����ȷ������_____��
A�����Ӵ��ķ�������һ�ֺ���������
B�����Ӵ�����������̼ԭ�Ӳ�������ͬһƽ����
C�����Ӵ�����FeCl3��Һ������ɫ��Ӧ����1mol���Ӵ��ܹ���3 mol��Br2ˮ��Ӧ
D�����Ӵ��ܷ����ķ�Ӧ������������Ӧ��ȡ����Ӧ���ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� �����ӷ���ʽ��д��ȷ����( )
A. ����ͨ��ˮ�У�Cl2��H2O = 2H����Cl����ClO��
B. ����ϡ���ᷴӦ��2Fe��6H�� = 2 Fe3����3H2��
C. ̼�������ᷴӦ��CaCO3��2H�� = Ca2����CO2����H2O
D. ��������������������Һ��Ӧ��Al(OH)3��OH�� = AlO2����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼW��X��Y��ZΪ�������ʣ�����ͷ����һ��ת���ij�����Ӧ�����г������ܽ��е��ǣ� ��
ѡ�� | W | X | Y | Z |
|
A | S | SO2 | SO3 | H2SO4 | |
B | Al | AlCl3 | NaAlO2 | Al2(SO4)3 | |
C | Fe | FeCl3 | Fe(OH)2 | FeCl2 | |
D | Na | Na2O2 | NaOH | NaCl |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.(1) ���º���ʱ��������˵���ϳɰ���Ӧ�ﵽƽ��״̬����_________��
a.������N2��H2��NH3��Ũ��֮��Ϊ1��3��2
b. v(N2)(��)=3v(H2)(��)
c.������ѹǿ���ֲ���
d.���������ܶȱ��ֲ���
e.��λʱ���ڶ���6molN-H����ͬʱ����3molH-H�γ�
f.��������ƽ������������
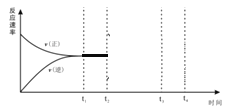
��.(2)�ں��º�ѹ�ܱ������г���1molN2��3molH2��t1ʱ�̴ﵽƽ��״̬��t2ʱ��������2mol NH3��t3ʱ�ﵽƽ�⣬����ͼ�л���v(��)��v(��) ��t2��t4��ı仯����_________��
��.�ɺϳ���(���ΪH2��CO��������CO2) ֱ���Ʊ������ѣ��漰���·�Ӧ��
�״��ϳɷ�Ӧ�� _____
(��)ʱCO(g)+2H2(g)![]() CH3OH(g) ��H1=-90.1kJ��mol-1�����Ѻϳɷ�Ӧ
CH3OH(g) ��H1=-90.1kJ��mol-1�����Ѻϳɷ�Ӧ
(��)2CH3OH(g)![]() CH3OCH(g)+H2O(g) ��H2=-23.9 kJ��mol-1
CH3OCH(g)+H2O(g) ��H2=-23.9 kJ��mol-1
(��)2CH3OH(g)![]() C2H4(g)+2H2O(g) ��H3=-29.1kJ��mol-1
C2H4(g)+2H2O(g) ��H3=-29.1kJ��mol-1
(1)�����Ѻϳɷ�Ӧ����������Ӧ�����仯��ͼ��ʾ��
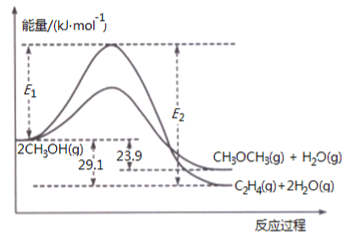
�ٷ�Ӧ���ʽϴ����__________(����š�������������)��˵��ԭ��________________��
�����������м����������E2-E1��__________(������ ���䡱��С��)��
(2)Kp����ƽ���ѹ����ƽ��Ũ�����õ�ƽ�ⳣ������ѹ=��ѹ�����ʵ���������һ���¶�ʱ���������г���2molH2��1molCO����Ӧ(��) ��ƽ��״̬ʱ������������ʵ���Ϊ2mol����ѹǿΪ2��105pa����KP___________Ϊ(��Ҫ����λ)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com