
【题目】下列离子方程式书写正确的是
A. 用FeCl3溶液腐蚀铜线路板:Cu + Fe3+ = Cu2+ + Fe2+
B. 向氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O
C. Na2O2固体与H2O反应产生O2 :2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑
D. 向酸性KMnO4溶液中通入SO2:3SO2+2MnO+4OH-== 2MnO2↓+3SO![]() +2H2O
+2H2O
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】Cu3N 具有良好的电学和光学性能在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用。
(1)C、N、O 三种元素的第一电离能由大到小的顺序为_________________。
(2)与N3-含有相同电子数的三原子分子的空间构型是____________。
(3)Cu+的电子排布式为___________,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO 为何会生成Cu2O:____________________。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙酸,乙醛分子中碳原子的杂化方式是___________,乙醛分子H-C-O的键角___________(填“大于”、“等于”或“小于”)乙醇分子中的H-C-O 的键角。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出Cu(H2O)2Cl2具有极性的分子的结构式:___________。
(6)Cu3N的晶胞结构如右图所示,N3-的配位数为___________,Cu+的半径为apm,N3-的半径为bpm,Cu3N的密度为___________g·cm-3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《神农本草经》记载,神农尝百草,日遇七十二毒,得茶而解。茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
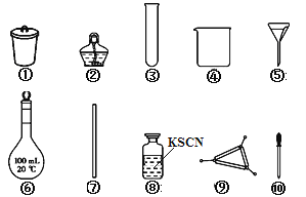
A. 将茶叶灼烧灰化,选用①、②和⑨
B. 用浓盐酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C. 过滤得到滤液,选用④、⑤和⑦
D. 检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
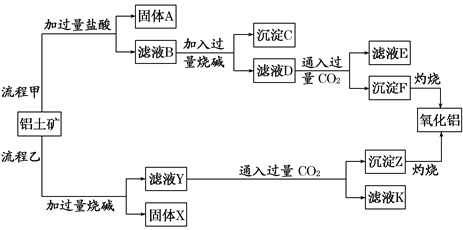
(1)写出流程甲加入盐酸后生成Al3+的离子方程式:___________________________。
(2)写出流程乙加入烧碱后生成SiO![]() 的离子方程式:___________________________。
的离子方程式:___________________________。
(3)为了验证滤液B中含Fe3+,可取少量滤液并加入___________(填试剂名称)。
(4)滤液E 、K中溶质的主要成分是_____(填化学式),写出该溶液的一种用途:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100 g质量分数为46%的乙醇(C2H6O)水溶液中含有的氧原子数为4NA
B. 2 mol Cu与100 mL浓度为18.4 mol·L1的浓硫酸在加热条件下充分反应,生成SO2分子数为0.92NA
C. 0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA
D. 0.1 mol/L的Ba(OH)2溶液中,OH的个数为0.2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
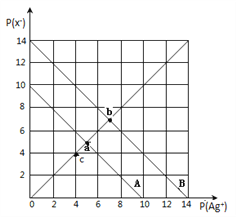
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铁的化合物在工业生产和日常生活中都有广泛的用途。请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:________________________________。
铁锈的主要成分是____________(填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:_____________________。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
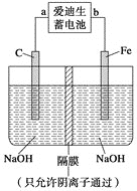
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是__________。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式__________________________。
③你认为高铁酸钠作为一种新型净水剂的理由可能是______。
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温、常压下,取下列四种气态烃各1 mol,分别在足量的氧气中燃烧,消耗氧气最多的是( )
A.CH4B.C3H8C.C4H10D.C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是
A. SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高
B. Al(OH)3能溶于NaOH溶液,则Be(OH)2能溶于NaOH溶液
C. 钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂
D. F2在暗处遇H2即爆炸,I2在暗处遇H2爆炸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com