
【题目】类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是
A. SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高
B. Al(OH)3能溶于NaOH溶液,则Be(OH)2能溶于NaOH溶液
C. 钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂
D. F2在暗处遇H2即爆炸,I2在暗处遇H2爆炸
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 用FeCl3溶液腐蚀铜线路板:Cu + Fe3+ = Cu2+ + Fe2+
B. 向氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O
C. Na2O2固体与H2O反应产生O2 :2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑
D. 向酸性KMnO4溶液中通入SO2:3SO2+2MnO+4OH-== 2MnO2↓+3SO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关油脂的说法错误的是
A. 植物油兼有酯类和烯烃的性质
B. 油脂的水解叫皂化反应
C. 液态油催化加氢后可以生成固态脂肪
D. 脂肪里的饱和烃基的相对含量较大,熔点较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,位于周期表的_____区,基态原子价电子排布图为_______。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有_______。
(3)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm +ICH2CH2I→SmI2+CH2=CH2。
ICH2CH2I中碳原子杂化轨道类型为______, lmol CH2=CH2中含有的σ键数目为______。常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是__________。
(4) PrO2(二氧化镨)的晶体结构与CaF2相似,晶饱中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有________个氧原子。
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。晶胞中Ce(铈)原子的配位数为_______,列式表示Ce(铈)单质的密度:________g/cm3(用NA表示阿伏伽德罗常数的值,不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过CO传感器可监测CO的含量,总反应为2K2FeO4+3CO+2KOH+2H2O=2Fe(OH)3+3K2CO3,其工作原理示意图如下,下列说法正确的是
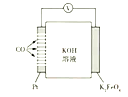
A. 电极为负极,可以用Fe电极代替
B. 工作时OH-向K2FeO4电极移动
C. 每转化3molCO,有2molK2FeO4被氧化
D. K2FeO4电极上的电极反应式是2FeO42-+8H2O+6e-=2Fe(OH)3↓+10OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,X与M同主族,Z的气态氧化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。清回答下列问题:
(1)Q的元素符号为______,Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号)___________。
(2)Y在元素周期表中的位置为_______________,Y与硫元素形成的二元化合物的电子式为_________________________。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)____________________。
(4)单质Y和元素Z的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为_________。
(5)Z和G组成的化合物GZ,被大量用于制造电子元件。工业上用G的氧化物、Y单质和Z单质在高温下制备GZ,其中G的氧化物和Y单质的物质的量之比为1:3,则该反应的化学方程式为__________________________。
(6)常温下,不能与G的单质发生反应的是(填序号)_________________________。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世上万物、神奇可测,其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_____(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为____,Q2+的未成对电子数是_____。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①制元素在周期表中的位置是______,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有______(填字母)。
A离子键 B金属键 C.配位键 D.非极性键 E极性键
③NH3中N原子的杂化轨道类型是______,写出一种与SO42-互为等电子体的分子的化学式:_ ______。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为_________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示。则该化合物的化学式为_____,如果该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____(用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com