
【题目】下列叙述中正确的有
①![]() 该原子的电子排布图,最外层违背了洪特规则
该原子的电子排布图,最外层违背了洪特规则
②处于最低能量状态原子叫基态原子,![]() 过程中形成的是发射光谱
过程中形成的是发射光谱
③运用价层电子对互斥理论,![]() 离子的空间构型为三角锥型
离子的空间构型为三角锥型
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3 中 N-Cl 键的键长比 CCl4 中 C-Cl 键的键长短
A.1 个B.2 个C.3 个D.4 个
【答案】B
【解析】
①洪特规则内容是电子在能量相同的轨道上排布时,总是尽可能分占不同的轨道且自旋方向相同,该轨道式违背了洪特规则,①说法正确;
②处于最低能量状态原子叫基态原子,排布式为1s22s22px1和1s22s22py1电子能量相同,1s22s22px1→1s22s22py1过程中没有能量释放,②说法错误;
③CO32-的中心原子为C原子,价层电子对个数为=![]() =3, C原子sp2杂化,轨道构型为平面三角形,成键原子有三个,分子空间构型为平面三角形,③说法错误;,
=3, C原子sp2杂化,轨道构型为平面三角形,成键原子有三个,分子空间构型为平面三角形,③说法错误;,
④具有相同核外电子排布的粒子如O2-、Mg2+核外都有10个电子,其电子层结构相同,前者具有还原性,后者具有氧化性,化学性质不同,④说法错误;
⑤N原子的半径小于C原子的半径,所以NCl3 中 N-Cl 键的键长比 CCl4 中 C-Cl 键的键长短,⑤说法正确;
答案选B。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】用“![]() ”或“
”或“![]() ”回答下列问题
”回答下列问题
①元素的非金属性越强,其对应最高价氧化物水化物的酸性越______;
②元素的金属性越强,其对应最高价氧化物水化物的碱性越______;
③元素的______性越强,其对应气态氢化物的稳定性越______;
④酸性:![]() ______
______![]() ;气态氢化物稳定性:
;气态氢化物稳定性:![]() ______HCl。
______HCl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
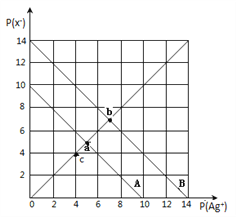
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(l)====2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)
(1)反应(Ⅰ)中氧化剂是_____________________________。
(2)火箭残骸中常出现红棕色气体,原因为:N2O4(g) ![]() 2NO2(g)(Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为_______(填“吸热”或“放热”)反应。
2NO2(g)(Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为_______(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是____________。

若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数______(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)= ________mol·L-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A. ![]() ,
,![]() 完全反应转移的电子数为
完全反应转移的电子数为![]()
B. 用电解粗铜的方法精炼铜,当电路中通过的电子数为![]() 时,阳极应有
时,阳极应有![]() 转化为
转化为![]()
C. 常温下,![]() 的
的![]() 溶液中,水电离出的
溶液中,水电离出的![]() 数为
数为![]()
D. ![]() 浓度为
浓度为![]() 的
的![]() 溶液中,阴离子数为
溶液中,阴离子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是

A. M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(用元素符号或化学式回答下列问题)
(1)在这些元素中,化学性质最不活泼的是_______,其原子结构示意图是_________。
(2)用电子式表示元素④与⑦组成的化合物的形成过程:________,该化合物属于_______(填“共价”或“离子”)化合物。
(3)常温下呈液态的非金属单质是_______。
(4)表中能形成两性氢氧化物的元素是_________,该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式是___________。
(5)①、⑥、⑦三种元素的最高价氧化物对应的水化物中,按酸性增强的顺序排列为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ. ![]()
![]()
Ⅱ. ![]()
![]()
Ⅲ. ![]()
![]()
回答下列问题:
(1)![]() _________
_________![]() 。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为__________mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
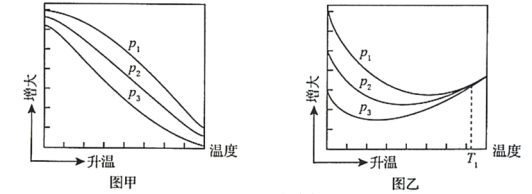
已知:CO2的平衡转化率=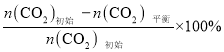
CH3OH的平衡产率=![]()
其中纵坐标表示CO2平衡转化率的是图___________(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________;图乙中T1温度时,三条曲线几乎交于一点的原因是___________。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________(填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com