
【题目】亚铁氰化钾属于欧盟批准使用的食品添加剂,受热易分解: 3K4[Fe(CN)6]![]() 12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
A.Fe2+的最高能层电子排布为 3d6
B.配合物K4[Fe(CN)6]中配位原子是碳原子
C.(CN)2分子中σ键和π键数目比为 3:4
D.已知 Fe3C 晶胞中每个碳原子被 6 个铁原子包围,则铁的配位数是 2
【答案】A
【解析】
A.Fe为26号元素,其原子核外共有26个电子,Fe原子失去4s轨道上的2个电子得到Fe2+,则Fe2+的核外电子排布式为1s22s22p63s23p63d6,其最高能层电子排布为3s23p63d6,A选项错误;
B.配合物K4[Fe(CN)6]中配体为CN-,由于电负性N>C,所以C原子提供孤对电子,即配位原子是碳原子,B选项正确;
C.(CN)2分子的结构式为N≡C—C≡N,单键为σ键,三键含有1个σ键和2个π键,因此(CN)2分子中σ键和π键数目比为3:4,C选项正确;
D.Fe3C的晶胞结构中碳原子的配位数为6,与碳原子紧邻的铁原子,以C原子为原点建立三维坐标系,Fe原子位于坐标轴上且关于原点(碳原子)对称,6个Fe形成的空间结构为正八面体,故C原子的配位数为6,配位数之比等于相应原子数目反比,则Fe原子配位数为![]() ,D选项正确;
,D选项正确;
答案选A。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】物质间纷繁复杂的转化关系是化学的魅力所在,下列选项中物质的转化在一定条件下不能一步实现的是( )
A.Si![]() SiO2
SiO2![]() SiB.NO2
SiB.NO2![]() HNO3
HNO3![]() NO2
NO2
C.Fe![]() FeCl3
FeCl3![]() FeD.S
FeD.S![]() SO2
SO2![]() S
S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种酸式盐AHB,它的水溶液显弱碱性,今有下列说法,其中正确的是
A.相同温度相同浓度的AOH溶液和H2B溶液,电离程度前者大于后者
B.HB—的电离程度大于HB—的水解程度
C.该盐的电离方程式为AHB=A++H++B2—
D.在溶液中离子浓度大小顺序一般为:c(A+)>c(OH—)>c(HB—)>c(B2—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究性学习小组欲用酸碱中和滴定法测定市售白醋的总酸量(g·100mL-1)。有关操作如下:
Ⅰ.实验步骤
(1)用________(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.1000mol·L-1NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(4)滴定。当__________________________________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(1)处理数据可得:c(市售白醋)=________mol·L-1;市售白醋总酸量=________g·100mL-1。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 SO2 分别通入无氧、有氧的浓度均为 0.1 mol·L-1的 BaCl2 溶液和 Ba(NO3)2 溶液中,除 BaCl2 溶液(无氧)外,都产生白色沉淀。实验测得各溶液 pH 变化曲线如图:
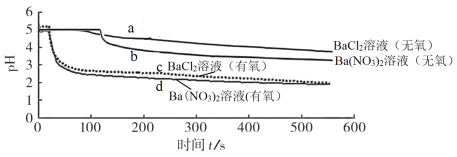
下列说法正确的是
A.曲线a所示溶液pH降低的原因:SO2+H2O![]() H2SO3
H2SO3![]() H++HSO
H++HSO![]()
B.依据曲线b可推知0.2 mol·L-1KNO3溶液(无氧)能氧化SO2
C.曲线c所示溶液中发生反应的离子方程式为:Ba2++SO2+O2=BaSO4↓
D.曲线d所表示的过程中NO![]() 是氧化SO2的主要微粒
是氧化SO2的主要微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是工业生产硝酸铵的流程。
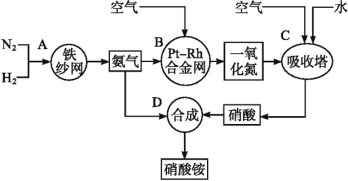
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:__。
(2)B装置中Pt-Rh合金网的作用是__,写出B中有关反应方程式:__。
(3)写出D中反应方程式:___。
(4)吸收塔C中通入空气的目的是___。A、B、C、D四个容器中的反应,属于氧化还原反应的是__(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,回答下列问题:

(1)该注射液中葡萄糖的质量分数为___________;
(2)该注射液中葡萄糖的物质的量浓度为__________。(保留两位小数)
(3)检测人的血液中葡萄糖(简称血糖,相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH = –511kJmol-1

可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a管的作用是________。
(2)A中反应的离子方程式是________。
(3)D的作用是________。
(4)E中冷却水的作用是________。
(5)尾气处理时,可选用的装置是________(填序号)。

(6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有________(填序号)。
A.蒸馏烧瓶 B.温度计 C.接收器 D.冷凝管 E.吸滤瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com