
【题目】如图所示是工业生产硝酸铵的流程。
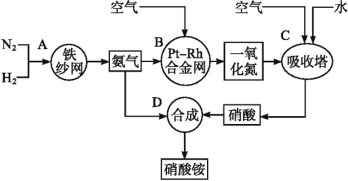
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:__。
(2)B装置中Pt-Rh合金网的作用是__,写出B中有关反应方程式:__。
(3)写出D中反应方程式:___。
(4)吸收塔C中通入空气的目的是___。A、B、C、D四个容器中的反应,属于氧化还原反应的是__(填字母)。
【答案】N+3H![]() 2NH3 催化作用 4NH3+5O2
2NH3 催化作用 4NH3+5O2 4NO+6H2O NH3+HNO3=NH4NO3 使NO全部转化成HNO3 A、B、C
4NO+6H2O NH3+HNO3=NH4NO3 使NO全部转化成HNO3 A、B、C
【解析】
氮气与氢气在铁作催化剂的条件下反应生成氨气,氨气与空气中的氧气反应生成NO,再与空气中的氧气、水反应生成硝酸,硝酸与氨反应生成硝酸铵。据此解答。
(1)N2和H2通过红热的铁纱网生成氨气,方程式为N+3H![]() 2NH3;
2NH3;
(2)氨气与氧气在催化剂的条件下生成NO,则合金网的作用为催化作用;方程式为4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(3)氨与硝酸反应生成硝酸铵,方程式为NH3+HNO3=NH4NO3;
(4)NO与水不反应,通入空气后,氧气与NO和水反应生成硝酸,则空气可使NO全部转化成HNO3;根据分析可知,A、B、C、D四个容器中,A、B、C的反应为氧化还原反应,D中为非氧化还原反应。


科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素构成的双原子单质分子有3种,其分子量分别为158、160、162。在天然单质中,此三种单质的物质的量之比为1︰1︰1,由此推断的以下结论中,正确的是( )
A.此元素有三种同位素
B.其中质量数为79的同位素原子占原子总数的1/2
C.其中一种同位素的质量数为80
D.此元素的单质的平均分子量为160
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾属于欧盟批准使用的食品添加剂,受热易分解: 3K4[Fe(CN)6]![]() 12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
A.Fe2+的最高能层电子排布为 3d6
B.配合物K4[Fe(CN)6]中配位原子是碳原子
C.(CN)2分子中σ键和π键数目比为 3:4
D.已知 Fe3C 晶胞中每个碳原子被 6 个铁原子包围,则铁的配位数是 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有淀粉的 KIO3 酸性溶液滴加 NaHSO3 溶液,溶液先变蓝后褪色。下列说法错误的是
A.溶液先变蓝的原因:2IO![]() +5HSO
+5HSO![]() =I2+5SO
=I2+5SO![]() +H2O+3H+
+H2O+3H+
B.溶液恰好褪色时 n(KIO3):n(NaHSO3)=1:3
C.还原性 I-> HSO![]() >I2
>I2
D.若向含有淀粉的 NaHSO3 溶液中滴加过量 KIO3 酸性溶液,则溶液变蓝不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答下列问题:
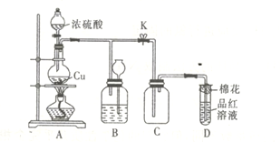
(1)装置A中发生反应的化学方程式为________________________。
(2)装置D中试管口放置的棉花应用一种液体浸泡一下,这种液体是_____,其作用是______。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭弹簧夹K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是___________________。B中应放置的液体是___(填字母)。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现圆底烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_______________________。
②下列药品中能用来证明反应结束后的圆底烧瓶中确有余酸的是_________(填字母)。
a.铁粉 b.BaC12溶液 c.银粉 d.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,充入2 mol A和1 mol B发生如下反应:2A(g)+B(g) ![]() xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
A.5 B.4 C.3 D.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图乙是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示( )
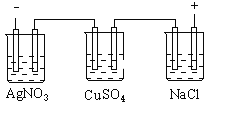
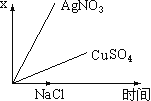
甲 乙
A. 各电池析出气体体积总数的变化B. 各电解池阳极质量的增加
C. 各电解池阴极质量的增加D. 各电极上放电的离子总数的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是

A. Ka(HA)=1×10-6
B. b点c(B+)=c(A-)=c(OH-)=c(H+)
C. a→c过程中水的电离程度始终增大
D. c点时,c(A-)/[c(OH-)c(HA)]随温度升高而减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com