
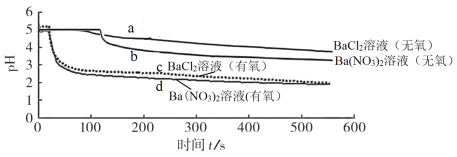
【题目】将 SO2 分别通入无氧、有氧的浓度均为 0.1 mol·L-1的 BaCl2 溶液和 Ba(NO3)2 溶液中,除 BaCl2 溶液(无氧)外,都产生白色沉淀。实验测得各溶液 pH 变化曲线如图:
下列说法正确的是
A.曲线a所示溶液pH降低的原因:SO2+H2O![]() H2SO3
H2SO3![]() H++HSO
H++HSO![]()
B.依据曲线b可推知0.2 mol·L-1KNO3溶液(无氧)能氧化SO2
C.曲线c所示溶液中发生反应的离子方程式为:Ba2++SO2+O2=BaSO4↓
D.曲线d所表示的过程中NO![]() 是氧化SO2的主要微粒
是氧化SO2的主要微粒
【答案】AB
【解析】
A.曲线a表示无氧环境下,氯化钡溶液 pH变化减小,说明二氧化硫与水反应生成了弱酸亚硫酸,溶液pH降低的原因是SO2+H2O![]() H2SO3
H2SO3![]() H++HSO
H++HSO![]() ,A选项正确;
,A选项正确;
B.根据曲线b可知,0.1 mol·L-1的Ba(NO3)2在无氧环境下可以氧化二氧化硫,依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2,B选项正确;
C.曲线c表示有氧环境下,氯化钡溶液pH变化较大,则说明二氧化硫被氧气氧化为强酸硫酸,反应的方程式是2Ba2++O2 +2SO2+2H2O=2BaSO4↓+4H+,C选项错误;
D.氯化钡、硝酸钡在有氧环境下,pH变化几乎相同,所以不能说明曲线d所表示的过程中NO![]() 是氧化SO2的主要微粒,D选项错误;
是氧化SO2的主要微粒,D选项错误;
答案选AB。


科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ表示t0时升温对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若室温下0.1mol·L-1NaX溶液中pH=9,则该溶液中发生水解反应的X-占全部X-的( )
A.0.01%B.0.09%C.1.0%D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学化学反应原理,解决以下问题:
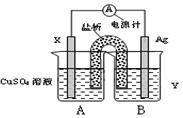
(1)依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池,可以提供稳定的电流.装置如图所示,其中盐桥中装有琼脂-饱和KCl溶液。
回答下列问题:
①电极X的材料和电解质溶液Y分别为________、________;
②盐桥中K+移向________(填A或B);
③银电极发生的电极反应式为________;
④该电池工作时,假设电路中有0.1mol电子转移,则X电极质量改变量为________克。
(2)已知:C(s)+O2(g)═CO2(g) △H1=-396.5kJmol-1;
H2(g)+![]() O2═H2O(g) △H2=-241.8kJmol-1;
O2═H2O(g) △H2=-241.8kJmol-1;
CO(g)+![]() O2(g)═CO2(g) △H3=-283.0kJmol-1.
O2(g)═CO2(g) △H3=-283.0kJmol-1.
根据盖斯定律写出单质碳和水蒸气生成水煤气的热化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾属于欧盟批准使用的食品添加剂,受热易分解: 3K4[Fe(CN)6]![]() 12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
A.Fe2+的最高能层电子排布为 3d6
B.配合物K4[Fe(CN)6]中配位原子是碳原子
C.(CN)2分子中σ键和π键数目比为 3:4
D.已知 Fe3C 晶胞中每个碳原子被 6 个铁原子包围,则铁的配位数是 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO 等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:
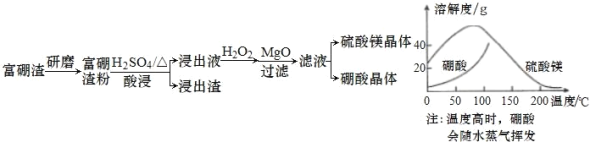
为了获得晶体,会先浓缩溶液接近饱和,然后将浓缩液放入高压釜中,控制温度进行结晶(硫酸镁与硼酸溶解度随温度的变化如图)。下列说法错误的是
A.该工艺流程中加快反应速率的措施有 2 种
B.在高压釜中,先降温结晶得到硼酸晶体,再蒸发结晶得到硫酸镁晶体
C.“酸浸”中镁硼酸盐发生反应2MgO·B2O3+2H2SO4+H2O![]() 2MgSO4+2H3BO3
2MgSO4+2H3BO3
D.加入“MgO”后过滤,所得滤渣主要是Al(OH)3 和Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答下列问题:
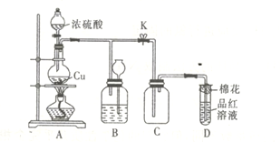
(1)装置A中发生反应的化学方程式为________________________。
(2)装置D中试管口放置的棉花应用一种液体浸泡一下,这种液体是_____,其作用是______。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭弹簧夹K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是___________________。B中应放置的液体是___(填字母)。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现圆底烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_______________________。
②下列药品中能用来证明反应结束后的圆底烧瓶中确有余酸的是_________(填字母)。
a.铁粉 b.BaC12溶液 c.银粉 d.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
(1)取冰醋酸配制250 mL 0.4 mol·L-1的醋酸溶液,用0.4 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示。则稀释过程中溶液的pH由大到小的顺序______(填字母)。

②配制250 mL 0.4 mol·L-1 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和____________。
③为标定该醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_______________(多选、错选不得分)。
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度( mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是______________________________________________________________。
②简述用pH试纸测 0.1mol·L-1 醋酸溶液pH的方法___________。
③利用水解理论设计实验证明醋酸的酸性比碳酸的强:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的电子层结构,电子式为如图所示:下列说法正确的是( )
![]()
A.NH5属于离子化合物
B.NH5属于共价化合物
C.NH5只含有离子键
D.NH5只含有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com