
【题目】请根据所学化学反应原理,解决以下问题:
(1)依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池,可以提供稳定的电流.装置如图所示,其中盐桥中装有琼脂-饱和KCl溶液。
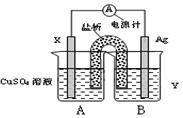
回答下列问题:
①电极X的材料和电解质溶液Y分别为________、________;
②盐桥中K+移向________(填A或B);
③银电极发生的电极反应式为________;
④该电池工作时,假设电路中有0.1mol电子转移,则X电极质量改变量为________克。
(2)已知:C(s)+O2(g)═CO2(g) △H1=-396.5kJmol-1;
H2(g)+![]() O2═H2O(g) △H2=-241.8kJmol-1;
O2═H2O(g) △H2=-241.8kJmol-1;
CO(g)+![]() O2(g)═CO2(g) △H3=-283.0kJmol-1.
O2(g)═CO2(g) △H3=-283.0kJmol-1.
根据盖斯定律写出单质碳和水蒸气生成水煤气的热化学方程式:________。
【答案】Cu AgNO3溶液 B Ag++e-=Ag 3.2 C(s)+H2O(g)=CO(g)+H2(g) △H=+128.3kJmol-1;
【解析】
(1)①氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)中失电子的金属Cu为负极,得电子的阳离子Ag+是电解质中的阳离子,所以电解质可以选择AgNO3溶液;
②原电池反应,B池中Ag+析出,为满足溶液的电中性,盐桥中的钾离子移向B池;
③银电极发生的电极反应为溶液中的银离子得到电子析出银单质,电极反应为:Ag++e-=Ag;
④铜电极是负极,电极反应式为Cu-2e-=Cu2+,该电池工作时,假设电路中有0.1mol电子转移,则X电极质量改变量为0.05mol×64g/mol=3.2g;
(2)已知:①已知:C(s)+O2(g)=CO2(g)△H1=-396.5kJmol-1
②H2(g)+![]() O2(g)=H2O(g)△H2=-241.8kJmol-1
O2(g)=H2O(g)△H2=-241.8kJmol-1
③CO(g)+![]() O2(g)=CO2(g)△H3=-283.0kJmol-1
O2(g)=CO2(g)△H3=-283.0kJmol-1
根据盖斯定律,①-②-③得到:单质碳和水蒸气生成水煤气的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g) △H=+128.3kJmol-1。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】Cu在加热条件下能与浓硫酸反应(反应Ⅰ),但工业上制取CuSO4却不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断由容器的下部吹入细小的空气泡(反应Ⅱ)。
(1)写出反应Ⅰ、Ⅱ的化学方程式___、___。
(2)试分析反应Ⅱ的制备办法的优点___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中硫、氮的氧化物是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等。某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成三份,进行如下实验:
试样 | 所加试剂 | 实验现象 |
第一份试液 | 滴加适量的淀粉KI溶液 | 溶液呈蓝色 |
第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀产生 |
第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体的物质的量(n)的关系如图 |
|
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是____,不能确定的离子有___。
(2)写出第一份试液滴加淀粉KI溶液时发生反应的离子方程式:____。
(3)第三份试液滴加NaOH溶液,加热,整个过程中发生了多个反应,写出其中两个反应的离子方程式:
①最初发生的离子反应____。
②最后发生的离子反应____。
(4)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
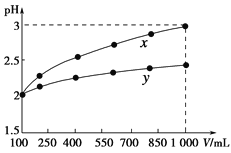
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,请填写下列空白:
(1)移取10.00mL密度为ρg/mL的过氧化氢溶液至250mL容量瓶中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式,请将相关物质的化学计量数及化学式填写在方框里。__________
![]() MnO4-+
MnO4-+![]() H2O2+
H2O2+![]() H+=
H+=![]() Mn2++
Mn2++![]() H2O+
H2O+![]()
![]()
(3)滴定时,将高锰酸钾标准溶液注入_____(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是________。
(4)复滴定三次,平均耗用cmol/LKMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 SO2 分别通入无氧、有氧的浓度均为 0.1 mol·L-1的 BaCl2 溶液和 Ba(NO3)2 溶液中,除 BaCl2 溶液(无氧)外,都产生白色沉淀。实验测得各溶液 pH 变化曲线如图:
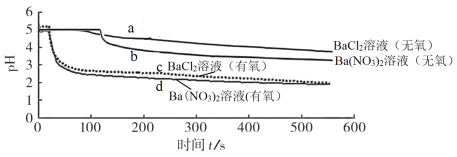
下列说法正确的是
A.曲线a所示溶液pH降低的原因:SO2+H2O![]() H2SO3
H2SO3![]() H++HSO
H++HSO![]()
B.依据曲线b可推知0.2 mol·L-1KNO3溶液(无氧)能氧化SO2
C.曲线c所示溶液中发生反应的离子方程式为:Ba2++SO2+O2=BaSO4↓
D.曲线d所表示的过程中NO![]() 是氧化SO2的主要微粒
是氧化SO2的主要微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物。
试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______。
(2)D元素位于周期表中______周期___________族。
(3)写出AB2与C2B2反应的化学方程式________________________________________________。
(4)画出B的原子结构简图 ___________________。
(5)用电子式表示化合物 C2D 的形成过程:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com