
| A. | 若X为单质铝,则Y的气体产物只能是氢气 | |
| B. | 若X为NaHCO3,则Z一定有CO2 | |
| C. | 若Y、Z为含铝元素的两种盐,则X一定为Al(OH)3 | |
| D. | 若X为乙酸乙酯,则生成物Y、Z中均含有乙醇 |
分析 A.Y为浓硫酸、硝酸时,与Al反应不生成氢气;
B.碳酸氢钠与强碱反应转化为正盐;
C.X为Al,Y为铝盐,Z为偏铝酸盐,符合转化关系;
D.乙酸乙酯酸性条件发生水解反应生成乙酸与乙醇,在碱性条件下水解生成乙酸钠与乙醇.
解答 解:A.Y为浓硫酸、硝酸时,属于氧化性酸,与Al反应不生成氢气,故A错误;
B.碳酸氢钠与强碱反应转化为正盐,没有二氧化碳生成,故B错误;
C.若X为Al,Y为铝盐,Z为偏铝酸盐,符合转化关系,故C错误;
D.乙酸乙酯酸性条件发生水解反应生成乙酸与乙醇,在碱性条件下水解生成乙酸钠与乙醇,生成物Y、Z中均含有乙醇,故D正确,
故选:D.
点评 本题考查无机物推断,属于开放性题目,熟练掌握物质的性质是解题关键,难度中等,注意利用反例法进行分析解答.


科目:高中化学 来源: 题型:选择题
| A. | 20mL 0.5mol/L AlCl3溶液 | B. | 30mL 1mol/L KCl溶液 | ||
| C. | 7.5mL 2mol/L MgCl2溶液 | D. | 10mL 3mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
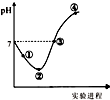 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | 曲线起点处水的电离程度最大,可用pH试纸测定溶液pH | |
| B. | ②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO- | |
| C. | 氯气~氯水体系中:c(H+)=c(Cl2)+c(HClO)+c(ClO-) | |
| D. | ③点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | X位于元素周期表中第2周期、第ⅤA族 | |
| B. | Y的一种氢化物不稳定,易分解 | |
| C. | W的非金属性比Y的非金属性弱 | |
| D. | Z的最高价氧化物的水化物可与X的最高价氧化物的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.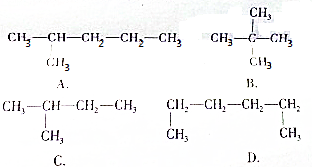
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
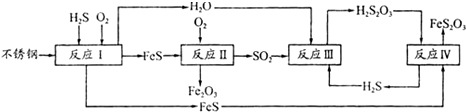

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu和Fe相连插入某溶液中形成原电池,则Fe一定作负极 | |
| B. | MgCl2中混有少量的FeCl3,可以通过溶解,加入过量MgO、过滤、结晶等操作进行提纯 | |
| C. | 用惰性电极电解CuSO4溶液一段时间后,若需加入适量的Cu(OH)2才能使溶液恢复到电解前状态,说明阴极只有Cu2+被还原 | |
| D. | 将Fe、Cu的混合物投入FeCl2和CuCl2的混合溶液中,最后可能只有Fe剩余 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
已知PbI2的Ksp = 7.0×l0-9,将7.5×l0-3 mol•L-1 的KI与一定浓度的Pb(NO3)2溶液按2∶1的体积比混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为( )
A. 8.4×l0-4 mol•L-1 B.5.6×l0-4 mol•L-1 C.4.2×l0-4 mol•L-1 D.2.8×l0-4 mol•L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com