
【题目】将V1 mL 1.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
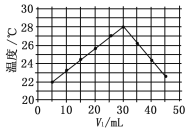
A.做该实验时环境温度为22℃
B.该实验表明化学能可转化为热能
C.NaOH溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
科目:高中化学 来源: 题型:
【题目】下述实验能达到预期目的的是( )
编号 | 实验内容 | 实验目的 |
A | 将Na2CO3和NaHCO3 的固体混合物加热灼烧 | 除去NaHCO3中的Na2CO3 |
B | 常温时将CO通过装有SiO2 的硬质玻璃管 | 制取粗硅 |
C | 向新制得的K2S溶液中滴加新制的氯水 | 比较氯与硫的得电子能力 |
D | 分别向2支盛有冷水的试管中加入相同大小的镁条和铝条。 | 比较镁铝的金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:
(1)可以用来鉴别甲烷和乙烯的试剂是 。
A.水
B.稀硫酸
C.溴水
D.酸性高锰酸钾溶液
(2)在一定条件下,乙烯能与水反应生成有机物A,则A的结构简式是 。
(3)某同学在学习A的知识后,设计了如下实验。操作步骤为:
①在试管里加入2 mL A;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有A的试管里,反复操作几次;
④闻生成物的气味,观察铜丝表面的变化。
第④步操作中,铜丝表面的变化是 ;写出第③步操作中发生反应的化学方程式: 。
(4)A在一定条件下可以被氧化成乙酸,用化学方程式说明乙酸和碳酸的酸性强弱: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种重要的工业原料,其结构简式如图:
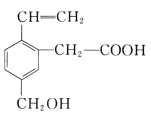
试回答下列问题:
(1)有机物A的分子式为 ;
(2)有机物A中含有的含氧官能团名称是 ;
(3)0.5 mol 该物质与足量金属钠反应,能生成标准状况下的氢气 L;
(4)该物质能发生的反应有 (填序号)。
①能与NaOH溶液反应
②能与溴的四氯化碳溶液反应
③能与甲醇发生酯化反应
④可以燃烧
⑤能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
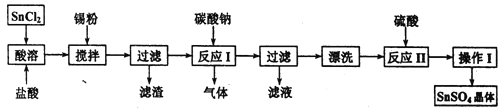
查阅资料:I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化
II.SnCl2易水解生成碱式氧化亚锡,Sn相对原子质量为119。
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是______。
(2)操作I是________________。
(3) SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因____________。
(4)加入Sn粉的作用有两个:①调节溶液:②______________。
(5)反应I中发生反应的离子方程式为:________。
(6)酸性条件下,SnSO4还可以用作H2O2去除剂,发生反应的离子方程式是:_______。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为Sn+2HCl=SnCl2+H2↑
②加入过量的FeCl3
③用已知浓度的K2Cr2O7,滴定生成的Fe2+,发生的反应为:Sn+2HCl=6FeCl3+2KCl+2CrCl3+7H2O
取1.226g锡粉,经上述各步反应后,共用去0.100mol/L K2Cr2O7溶液32.0mL。锡粉中锡的质量分数是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
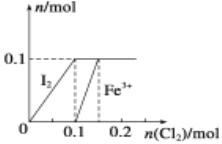
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为________>________>________;
(2)按顺序写出通入Cl2过程中发生反应的离子方程式为
__________________________________________;
__________________________________________;
__________________________________________。
(3)当溶液中n(Cl-)∶n(IO3-)=13∶2时,通入的Cl2在标准状况下的体积为________。
II.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。生产K2FeO4的工艺流程如下图所示:
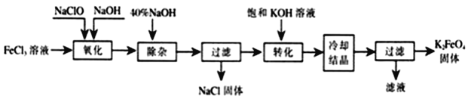
(1)写出“氧化”过程中生成Na2FeO4的离子方程式 。
(2)“转化”过程中发生的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼金属一般用热分解法、热还原法和电解法。采用的不同的冶炼方法。你认为选择的原则主要是依据 ( )
A. 金属熔点的高低
B. 金属阳离子得电子的能力
C. 金属在自然界的存在形式
D. 金属元素在地壳中的含量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com