
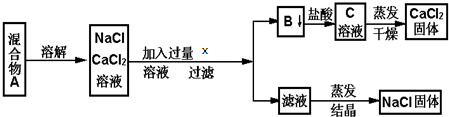
分析 分离NaCl和CaCl2两种固体混合物,溶解后加入过量碳酸钠溶液,生成碳酸钙沉淀和氯化钠,碳酸钙和盐酸发生:CaCO3+2H+=Ca2++CO2↑+H2O,得到氯化钙溶液,经蒸发可得到氯化钙固体;
由于碳酸钠过量,所以滤液中的物质有氯化钠和碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,加入稀盐酸最合适,碳酸钠和稀盐酸生成氯化钠和水和二氧化碳,蒸发后最后的固体物质是氯化钠.
解答 解:(1)分离NaCl和CaCl2两种固体混合物,溶解后加入过量碳酸钠溶液,生成碳酸钙沉淀和氯化钠,故答案为:Na2CO3;
(2)由于碳酸钠过量,所以滤液中的物质有氯化钠和碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,向滤液中加入适量盐酸至不产生气体,生成氯化钠和水和二氧化碳,蒸发后最后的固体物质是氯化钠,故答案为:加入适量盐酸至不产生气体;
(3)要测定该样品中NaCl和CaCl2的质量比,可称量干燥的碳酸钙的质量,根据反应CaCO3+2H+=Ca2++CO2↑+H2O可计算氯化钙的质量,混合物A的总质量减去氯化钙的质量可得氯化钠的质量,故答案为:A.
点评 本题考查物质的分离、提纯知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作方法,为解答该题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化产物与还原产物的粒子个数比为5:2 | |
| B. | 氧化产物与还原产物的粒子个数比为2:5 | |
| C. | 氧化剂与还原剂的粒子个数之比为1:8 | |
| D. | 氧化剂与还原剂的粒子个数之比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油是混合物 | |
| B. | 油脂是天然高分子化合物 | |
| C. | 铜的活动性比铁弱,可在海轮外壳装铜块减缓海轮腐蚀 | |
| D. | 氨气显碱性,可用浓硫酸干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LN2与CO混合气体的质量为28g | |
| B. | 常温常压下,金属与酸反应生成2g H2,转移电子数为2NA | |
| C. | 含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子 | |
| D. | 1L1mol•L-1的氨水,含NA个NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1种 | B. | 2种 | C. | 3 种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
下列说法或实验操作正确的是
A. 决定反应速率的主要因素有浓度、压强、温度
B. 容量瓶、量筒个滴定管上都标有使用温度,容量瓶无“0”刻度,量筒、滴定管有“0”刻度;实验时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
C. 为实验安全,金属钠切割下来的表层物质反应放回原试剂瓶,不能再研磨氯酸钾或硝酸钾
D. 皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬质酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com