
| A. | 氧化产物与还原产物的粒子个数比为5:2 | |
| B. | 氧化产物与还原产物的粒子个数比为2:5 | |
| C. | 氧化剂与还原剂的粒子个数之比为1:8 | |
| D. | 氧化剂与还原剂的粒子个数之比为1:5 |
分析 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,则KMnO4为氧化剂,生成MnCl2为还原产物,Cl元素的化合价由-1价升高为0,但在反应的16HCl(浓)中,被氧化的占10mol,未被氧化的HCl为6mol,所以10molHCl为还原剂,生成5molCl2为氧化产物,以此来解答.
解答 解:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,则KMnO4为氧化剂,生成MnCl2为还原产物,Cl元素的化合价由-1价升高为0,但在反应的16HCl(浓)中,被氧化的占10mol,未被氧化的HCl为6mol,所以10molHCl为还原剂,生成5molCl2为氧化产物,则氧化产物与还原产物的粒子个数比为5:2,氧化剂与还原剂的粒子个数之比为2:10=1:5,则AD正确;
故选:AD.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为H2O>NO>CO2 | |
| B. | 常温下,NO分解产生O2的反应的平衡常数表达式为K1=[N2]•[O2] | |
| C. | 常温下,2H2O(g)═2H2 (g)+O2(g),此时平衡常数的数值约为5×10-82 | |
| D. | 以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.
实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中P得到电子 | |
| B. | 消耗1mol KClO3时,转移5mol 电子 | |
| C. | 发令时看到白烟可能是P2O5固体颗粒 | |
| D. | 氧化剂与还原剂的物质的量比为6:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  白磷 | B. |  高锰酸钾 | C. |  过氧化氢 | D. |  浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂是HCl,还原剂是MnO2 | |
| B. | 每生成2 mol Cl2,转移电子的物质的量是4 mol | |
| C. | 每消耗1 mol MnO2,表现还原作用的HCl为4 mol | |
| D. | Cl2既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
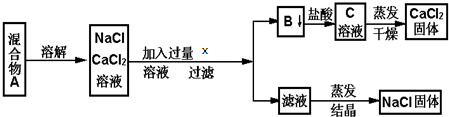
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com