
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) ![]() H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3=198 kJ·mol-1
H3=198 kJ·mol-1
(1)反应ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)的![]() H4=________kJ·mol-1。反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
H4=________kJ·mol-1。反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:![]()
该反应在一定条件下能自发进行的原因是_______;若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是________。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
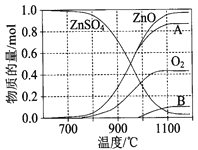
①写出700℃~980℃时发生反应的化学方程式:______________________________________________, 物质B的化学式是________________。
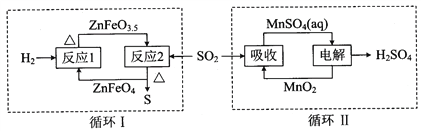
② 硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式:_____________________________________________;循环II中电解过程阳极反应式是_________________________________________。
【答案】 -377.5 △H<0 bd 2ZnSO4![]() 2ZnO+2SO2↑+O2↑ SO2 4ZnFeO3.5+SO2
2ZnO+2SO2↑+O2↑ SO2 4ZnFeO3.5+SO2![]() 4ZnFeO4+S Mn2+-2e-+2H2O=MnO2+4H+
4ZnFeO4+S Mn2+-2e-+2H2O=MnO2+4H+
【解析】(1)① 2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) △H1=-930 kJ·mol-1
②2C(s) + O2(g) = 2CO(g) △H2=-221 kJ·mol-1
③ZnO(s) + CO(g) = Zn(g) + CO2(g) △H3=198kJmol-1
根据盖斯定律,将方程式(①+②)÷2+③得ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g),△H4=(―930 kJ·mol-1―221 kJ·mol-1)÷2+198kJmol-1=-377.5kJmol-1;当△G=△H-T△S<0时反应一定能自发进行,因反应![]() 的△S<0,则焓变应该小于0;a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,故a错误;b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,故b正确;c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正=v(H2O)逆时该反应没有达到平衡状态,故c错误;d.因CO(NH2)2是固体,反应前后气体的密度改变,所以当容器中混合气体的密度不再改变时,该反应达到平衡状态,故d正确;故答案为:-377.5;△H<0;bd;
的△S<0,则焓变应该小于0;a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,故a错误;b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,故b正确;c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正=v(H2O)逆时该反应没有达到平衡状态,故c错误;d.因CO(NH2)2是固体,反应前后气体的密度改变,所以当容器中混合气体的密度不再改变时,该反应达到平衡状态,故d正确;故答案为:-377.5;△H<0;bd;
(2). ①. 据图可知,700℃~980℃发生反应时,生成ZnO、氧气和B,根据原子守恒可知,B中含有S原子,因为生成氧气失电子,则S元素应该得电子发生还原反应,所以B应该是SO2,根据反应物和生成物及反应条件可得反应方程式为:2ZnSO4![]() 2ZnO+2SO2↑+O2↑,故答案为:2ZnSO4
2ZnO+2SO2↑+O2↑,故答案为:2ZnSO4![]() 2ZnO+2SO2↑+O2↑;SO2;
2ZnO+2SO2↑+O2↑;SO2;
②. ZnFeO3.5和SO2在加热条件下生成ZnFeO4、S,反应方程式为4ZnFeO3.5+SO2 ![]() 4ZnFeO4+S;电解硫酸锰时,生成二氧化锰和硫酸,Mn2+在阳极上失电子发生氧化反应,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,故答案为:4ZnFeO3.5+SO2
4ZnFeO4+S;电解硫酸锰时,生成二氧化锰和硫酸,Mn2+在阳极上失电子发生氧化反应,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,故答案为:4ZnFeO3.5+SO2 ![]() 4ZnFeO4+S;Mn2+-2e-+2H2O=MnO2+4H+。
4ZnFeO4+S;Mn2+-2e-+2H2O=MnO2+4H+。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】粗盐中含可溶性CaCl2、MgCl2及Na2SO4,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,加入的先后顺序可以是
A. ①②③④ B. ②①③④ C. ②③①④ D. ①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系:a A(g)+b B(g)![]() c C(g)+d D(s) △H<0,下列判断中正确的是
c C(g)+d D(s) △H<0,下列判断中正确的是
A. 若(a+b) < (c+d),则反应一定能自发向右进行
B. 若起始时只充入A、B,且物质的量之比为a:b,则平衡时A、B的转化率之比为a:b
C. 若a+b = c+d,往含m mol气体的平衡体系中充入n mol B,则达到平衡时气体总物质的量等于(m+n)mol。
D. 若a+b = c,对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式错误的是( )
A.醋酸和足量的氢氧化钠溶液反应:H++OH﹣═H2O
B.溴化亚铁溶液中通入足量的氯气:2 Fe2++4 Br﹣+3 Cl2═2 Fe3++2 Br2+6 Cl﹣
C.用小苏打治疗胃酸过多:HCO ![]() +H+═CO2↑+H2O
+H+═CO2↑+H2O
D.碳酸氢铵稀溶液中加入过量的石灰水:Ca2++HCO ![]() +2 OH﹣+NH
+2 OH﹣+NH ![]() ═CaCO3↓+NH3?H2O+H2O
═CaCO3↓+NH3?H2O+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g)![]() SO2Cl2(l) △H= -97.3kJ/mol
SO2Cl2(l) △H= -97.3kJ/mol
(1)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是______(填写序号)。
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
(2)已知20℃时,AgCl的溶解度为0.00015 g,Ag2SO4的溶解度为0.796 g。则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是____________。
(3)300℃时,体积为1L的密闭容器中充入a mol SO2Cl2,达到平衡时容器中含SO2 b mol,则300℃时合成SO2Cl2反应的平衡常数为_____________。
(4)将(3)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量(写出计算过程)________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一家大型化工厂发生爆炸,有大量的Cl2扩散,下列应急措施不正确的是
A.向顺风方向的低洼处跑
B.用浸有纯碱液的毛巾捂住口鼻迅速逃离
C.向逆风方向的高处跑
D.来不及逃离的可用浸湿的棉被堵好门窗,并及时请求救援
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是( )
A.Na2CO3 NaCl NaOHB.NaCl NaOH Na2CO3
C.NaOH NaCl Na2CO3D.NaCl Na2CO3 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地在整顿音像市场的活动中,查获了一大批盗版光盘,并进行了“绿色销毁”。以下做法中,属于“绿色销毁”的是( )
A.泼上汽油焚烧
B.倾倒入江河中
C.深埋于土中
D.碾压粉碎后再回收利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com