
【题目】下列有机物的命名正确的是
A.1,2─二甲基戊烷 B.3─甲基己烷
C.4─甲基戊烷 D.2─乙基戊烷
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) ![]() H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3=198 kJ·mol-1
H3=198 kJ·mol-1
(1)反应ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)的![]() H4=________kJ·mol-1。反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
H4=________kJ·mol-1。反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:![]()
该反应在一定条件下能自发进行的原因是_______;若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是________。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
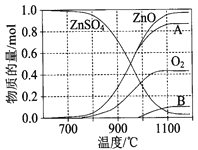
①写出700℃~980℃时发生反应的化学方程式:______________________________________________, 物质B的化学式是________________。
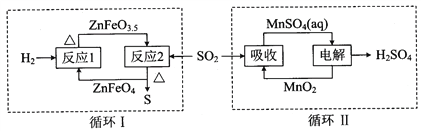
② 硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式:_____________________________________________;循环II中电解过程阳极反应式是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知外电路中,电子由铜流向a极.下图所示的装置分析合理的是( ) 
A.该装置中Cu极为正极
B.当铜极的质量变化为25.6g时,a极上消耗的O2在标准状况下的体积为4.48L
C.b极反应的电极反应式为:H2﹣2e﹣=2H+
D.一段时间后锌片质量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质.具体实验步骤如图所示:
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出.配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨)mL,用规格为mL量筒量取.
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42﹣外,还有大量的NH4+ . 检验NH4+的方法是 .
(3)写出沉淀物中所有物质的化学式 .
(4)滤液I的成分是水和 .
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:①称取钾氮肥试样并溶于水,加入足量溶液,产生白色沉淀.
②、、(依次填写实验操作名称).
③冷却、称重.
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:mol(用含m、n的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系:
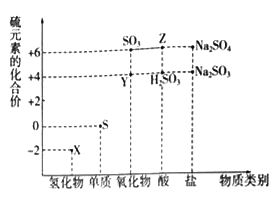
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式).
(2)将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为_______.
(3)检验物质Y的方法是_______________________________.
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______.
(5)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr207氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计).其中能表示等质量的氢气与氦气的是( )
A.
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白:
(1)用B表示的平均反应速率为 , A的转化率为 .
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度 , 混合气体平均相对分子质量(填“增大”、“减少”或“不变”).
(3)若开始时只加C和D各 ![]() mol,要使平衡时各物质的物质的量原平衡相等,则还应加入mol B物质.
mol,要使平衡时各物质的物质的量原平衡相等,则还应加入mol B物质.
(4)若向原平衡体系再投入1mol A和1mol B,平衡(填“右移、左移或不移”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com