
如图为四、五、六、七主族元素简单氢化物沸点随周期变化图像,(代表氢化A、B、C、D物中另外一种元素)分析图像并回答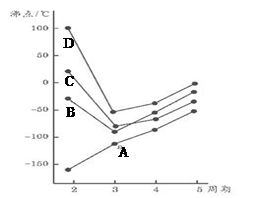
(1)写出B3-的空间构型
(2)B元素另外一种氢化物可做火箭的燃料,其电子式为:__________________,中心原子杂化方式为_______________
(3)A元素氧化物晶体类型为____________________,研究发现其氧化物晶胞中,A的位置与金刚石晶胞中碳原子位置相似,试分析晶胞中占有氧原子个数应为___________个。
(4)A、B、C、D第一电离能由小到大的顺序是____________________(用元素符号表示)
科目:高中化学 来源: 题型:填空题
硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等。
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取的。高温下制取纯硅有如下反应(方法1):
①SiO2(s)+2C(s) Si(s)+2CO(g)
Si(s)+2CO(g)
②Si(s)+2Cl2(g) SiCl4(g)
SiCl4(g)
③SiCl4(g)+2H2(g) →Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有 种不同能级的电子,最外层的p电子有 种自旋方向。
(2)硅与碳同主族,单质的还原性:碳 硅(填写“同于”、“强于”或“弱于”)。反应①之所以能进行的原因是 。
(3)反应②生成的化合物的电子式为 ;该分子为 分子(填写“极性”或“非极性”)。
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L。然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L。则:a b(填写“大于”、“等于”或“小于”)。
(5)在t秒内,反应②中v(SiCl4)= (用含a、b的代数式表示)。
(6)工业上还可以通过如下反应制取纯硅(方法2):
④Si(粗) +3HCl(g)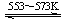 SiHCl3(l)+H2(g) + Q(Q>0)
SiHCl3(l)+H2(g) + Q(Q>0)
⑤SiHCl3(g)+H2(g) Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有: (选填2条)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期主族元素A、B、C、D、E、F的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,C原子最外层电子数是E原子最外层电子数的3倍,B、F原子最外层电子数之和等于C、E原子最外层电子数之和。
请回答下列问题:
(1)B元素在元素周期表中的位置为____________ 。
(2)元素C和D可形成两种化合物D2C、D2C2,其中均含有的化学键类型是______________;元素E、F形成的最高价氧化物对应水化物的碱性强弱关系为_____>_____ (填化学式)。
(3)E的单质能与A的最高价氧化物发生置换反应,反应的化学方程式为_____________;
(4)F的单质加入到D的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置: ,其原子核外有 种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是 (用元素符号表示)。
(2)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1,甲的电子式是_______________。
(3)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)
(4)Q与R两元素可组成多种分子,其空间构型可能是 (填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(5)X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体。请回答下列问题(涉及物质均用化学式表示)。
(1)离子化合物ZX中X离子的结构示意图为 ; Y在元素周期表中的位置是_______________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________,Q与G的气态氢化物还原性更强的是__________________。
(3)工业上制备M的高纯度单质,其中一个重要反应是:由MXG3与X2在高温下反应。该反应过程必须控制无水无氧,因为MXG3遇水剧烈反应生成H2、 和 ,而混入氧气,引起的后果是 。
(4)X2Q的燃烧热为a kJ·mol-1,下列X2Q燃烧反应的热化学方程式正确的是 。
| A.2X2Q(g) + O2(g) =" 2Q(s)" + 2X2O(g)△H=" -2a" kJ·mol-1 |
| B.X2Q(g) + 2O2(g) = QO3(g) + X2O(l)△H=" +a" kJ·mol-1 |
| C.2X2Q(g)+ 3O2(g) = 2QO2(g) + 2X2O(l)△H=" -2a" kJ·mol-1 |
| D.X2Q(g) + 2O2(g) = QO3(g) + X2O(l)△H=" -a" kJ·mol-1 |
 Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。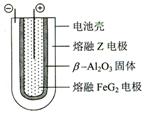
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、L、M、N是六种原子序数依次增大的前四周期元素。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。N的核电荷数比L的核电荷数的3倍多2, 回答下列问题:
(1)X和Y可以形成10电子、14电子、18电子分子,写出X元素质子数和中子数相等的核素的符号 。由X和Y元素组成的14电子分子的电子式为 。
(2)在水溶液中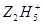 将Fe3+还原为Fe2+,
将Fe3+还原为Fe2+,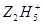 +4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
+4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
(3)一定条件下,M与TiO2、C(石墨)反应只生成M的氧化物和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知。该反应生成lmol M的氧化物时放出536kJ的热量,其热化学方程式为 。
(4)Z元素的气态氢化物和最高价氧化物对应的水化物化合生成一种盐,该盐的水溶液呈 (填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序 。
(5)N的低价硫酸盐溶液与过氧化钠反应。若N的低价硫酸盐与过氧化钠的物质的量之比为2:1,且无气体生成,则该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如下图所示。已知Y、Z的单质是空气的主要成分,W的原子半径在同周期中最小。请回答下列问题: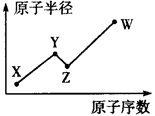
(1)写出化合物XWZ的电子式:_______________________。
(2)由W、Y两种元素组成的一种化合物M分子中,每个原子最外层均达到稀有气体的稳定结构,在工业生产中M大规模用于面粉的漂白和杀菌,写出M与水反应的化学方程式:________________。
(3)由W、X、Y、Z四种元素中的三种元素组成的某种化合物N是一种常见的化肥,若N能促进水的电离,则其化学式为____________________;若N能抑制水的电离,则其化学式为___________________。
(4)XYZ3溶液的酸性比XWZ溶液的酸性强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是部分短周期元素的常见化合价与原子序数的关系图: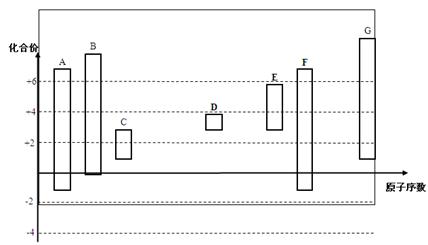
(1)元素A在周期表中的位置 。
(2)用电子式表示D2G的形成过程 其所含化学键类型为 。
(3)C2-、D+、G2-离子半径大小顺序是 > > (用离子符号回答)
(4)某同学设计实验证明A、B、F的非金属性强弱关系。 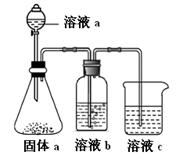
① 溶液a和b分别为 , 。
② 溶液c中的离子方程式为 。
③请从原子结构的角度解释非金属性B > A的原因 。
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中
① 转移电子的物质的量为 。
② 用一个离子方程式表示该反应 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com