
结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界,并在图中画出金属与非金属的分界线.
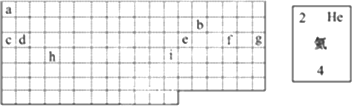
(2)表中所列元素,属于短周期元素的有________种,属于过渡元素的有________种;g元素位于第________周期________族;i元素位于第________周期________族.
(3)请在下边方框中按氦元素的式样写出元素f的原子序数、元素符号、元素名称、相对原子质量.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 元素 | X | Y | |
| 电离能/kJ?mol-1 | I1 | 762 | 717 |
| I2 | 1561 | 1509 | |
| I3 | 2957 | 3248 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D | E |
| 有关性质或结构信息 | 单质是空气中主要成分之一,其氢化物水溶液呈碱性 | 原子核外有两个未成对电子 | 日常生活中常见的金属,通常用电解法冶炼其单质 | 其简单阴离子带两个单位负电荷 | 单质有毒,常温下为有色气体,常用于自来水消毒 |

查看答案和解析>>
科目:高中化学 来源: 题型:
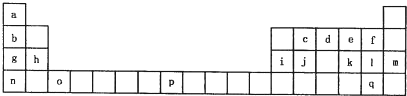
查看答案和解析>>
科目:高中化学 来源: 题型:
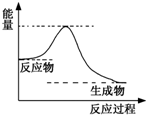
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中提供的是部分短周期元素的x的值:
元素 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
x | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
请回答下列问题:
(1)结合元素周期表的结构(周期、主族),推测元素的x值与原子半径的变化关系是____________。
指出元素周期表中,x值最小的元素位于____________(放射性元素除外)。
(2)分析N和Mg的x值范围为:
____________<x(N)<____________;
____________<x(Mg)<____________。
(3)若两元素的x值的差(Δx)大于1.7时,成键时一般形成离子键;小于1.7时,一般为共价键。则PCl3的电子式为____________;化合物BeCl2、LiCl熔点:BeCl2____________LiCl(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com