
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下0.1molC12溶于水,转移的电子数目为0.1NA
B. 1 L 0.1 molL-1氯化铁溶液中铁离子数为0.1NA
C. 0.1 molNa2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA
D. 标准状况下,2.24LNO和2.24LO2混合后气体分子数一定为0.15NA
【答案】C
【解析】A项,Cl2与水的反应为可逆反应,0.1molC12溶于水,转移的电子数目小于0.1NA,错误;B项,n(FeCl3)=0.1mol/L![]() 1L=0.1mol,Fe3+在溶液中发生水解,1 L 0.1 molL-1氯化铁溶液中铁离子数小于0.1NA,错误;C项,Na2O2与潮湿的CO2可发生的反应为:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,Na2O2无论与CO2还是与H2O反应,1molNa2O2参与反应都转移1mol电子,0.1 molNa2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA,正确;D项,n(NO)=2.24L
1L=0.1mol,Fe3+在溶液中发生水解,1 L 0.1 molL-1氯化铁溶液中铁离子数小于0.1NA,错误;C项,Na2O2与潮湿的CO2可发生的反应为:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,Na2O2无论与CO2还是与H2O反应,1molNa2O2参与反应都转移1mol电子,0.1 molNa2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA,正确;D项,n(NO)=2.24L![]() 22.4L/mol=0.1mol,n(O2)=2.24L
22.4L/mol=0.1mol,n(O2)=2.24L![]() 22.4L/mol=0.1mol,NO与O2发生反应2NO+O2=2NO2,生成0.1molNO2还剩余0.05molO2,但由于还存在反应:2NO2
22.4L/mol=0.1mol,NO与O2发生反应2NO+O2=2NO2,生成0.1molNO2还剩余0.05molO2,但由于还存在反应:2NO2![]() N2O4,则所含气体分子物质的量在0.1mol~0.15mol之间,错误;答案选C。
N2O4,则所含气体分子物质的量在0.1mol~0.15mol之间,错误;答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质的用途或变化,说法正确的是 ( )
A.碳酸钠是发酵粉的主要成分B.次氯酸钙是漂白粉的有效成分
C.SO2有漂白性可以用来漂白面条等食品D.N2与O2在放电条件下直接化合生成NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016盐城三模】实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
已知:①I2+Na2CO3═NaI+NaIO+CO2↑;△H<0
3I2+3Na2CO3═5NaI+NaIO3+3CO2↑;△H<0
②I2(s)+I﹣(aq)═I3﹣(aq);
③水合肼(N2H4H2O)具有强还原性,可分别将IO﹣、IO3﹣和I2还原为I﹣,本身被氧化为N2(放热反应);100℃左右水合肼分解为氮气和氨气等.
(1)常温常压时,I2与Na2CO3溶液反应很慢,下列措施能够加快反应速率的是 (填字母).
a.将碘块研成粉末 b.起始时加少量NaI
c.将溶液适当加热 d.加大高纯水的用量
(2)I2与Na2CO3溶液反应适宜温度为40~70℃,温度不宜超过70℃,除防止反应速率过快,另一个原因是 .
(3)加入稍过量水合肼发生反应的离子方程式为 (只写一个).
(4)整个实验过程中都需要开动搅拌器,其目的是 .
(5)反应的后期I2与Na2CO3溶液反应难以进行,此阶段需对投料顺序作适当改进,改进的方法是 .
(6)所得溶液(偏黄,且含少量SO42﹣,极少量的K+和Cl﹣)进行脱色、提纯并结晶,可制得高纯NaI晶体.实验方案为:在溶液中加入少量活性炭煮沸、
(实验中需使用的试剂有:HI溶液,Na2CO3溶液、Ba(OH)2溶液、高纯水及pH试纸;除常用仪器外须使用的仪器有:真空干燥箱)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】腈纶织物广泛地用作衣物、床上用品等.腈纶是由CH2═CH﹣CN聚合而成的,CH2═CH﹣CN可以由下列反应制得:
□CH3﹣CH═CH2+□NH3+□O2→□CH2═CH﹣CN+□H2O
丙烯可以由石脑油裂解制得:C10H22→2C3H6+X
(1)配平方程式:CH3﹣CH═CH2+NH3+O2→CH2═CH﹣CN+H2O
(2)写出上述反应式中X的同分异构体的结构简式;
(3)生物质含有葡萄糖、淀粉和纤维素等糖类,也称碳水化合物,绿色植物将二氧化碳和水变成碳水化合物,写出由二氧化碳和水变成葡萄糖的化学方程式;
(4)葡萄糖在碱性、加热条件下,能与(试剂名称)反应析出光亮的金属;在加热条件下,也可与新制的氢氧化铜反应,写出该反应现象 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
(1)Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间:
序号 | 反应 | c(H2O2)/ | V(H2O2) | m(MnO2) | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
a.设计实验2和实验3的目的是研究对化学反应速率的影响;
b.为研究温度对化学反应速率的影响,可以将实验和实验作对比(填序号);
c.将实验1和实验2作对比,t1t2(填“>”、“<”或“=”).
(2)Ⅱ.以KI和FeCl3反应为例(2Fe3++2I﹣2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1molL﹣1KI溶液②0.1molL﹣1 FeCl3溶液③0.1molL﹣1 FeCl2溶液
④0.1molL﹣1盐酸⑤0.1molL﹣1KSCN溶液⑥CCl4
实验步骤:
a.取5mL 0.1molL﹣1 KI溶液,再滴加几滴0.1molL﹣1 FeCl3溶液;
b.充分反应后,将溶液分成三份;
c.取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
d.另取一份,加试剂(填序号),现象,说明此反应存在一定的限度.
(3)Ⅲ.N2O4可分解为NO2 . 在100mL密闭容器中投入0.01mol N2O4 , 利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示: 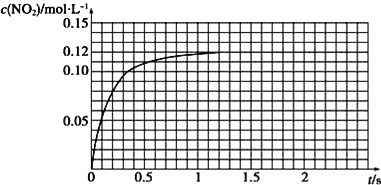
a.反应容器中最后剩余的物质有 , 其中N2O4的物质的量为mol;
b.c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后 . (选填“变大”,“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列溶液,一段时间后(原溶液溶质未完全反应),再加入一定质量的另一物质(中括号内),溶液能与原来溶液完全一样的是 ( )
A.CuCl2[CuCl2溶液]B.AgNO3[Ag2O]
C.NaCl[HCl溶液]D.CuSO4[Cu(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017宝山区二模】氮的单质及其化合物性质多样,用途广泛.
完成下列填空.
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO![]() 2CO2+N2+Q(Q>0)
2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间的CO浓度如表:
时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
该反应平衡常数K的表达式为 ;温度升高,K值 (选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)= ;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是 .
(2)工业合成氨的反应温度选择500℃左右的原因是 .
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是 .
a.N2、H2、NH3的浓度之比为1:3:2
b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是 ;在通入NH3的过程中溶液的导电能力 (选填“变大”、“变小”、“几乎不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步实验直接完成的是( )
A.Al(OH)3→Al2O3B.Al2O3→Al(OH)3C.Al→AlO2﹣D.Al3+→AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017青山区模拟】某温度下,在体积不变的容器中进行反应:CO(g)+2H2(g)CH3OH(g)△H1=﹣90.7kJmol﹣1.已知反应的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L;5min后反应达平衡,此时CO的转化率为50%.则下列说法正确的是( )
A.该反应属于熵增放热反应,一定能自发进行
B.5 min内H2的平均反应速率为0.1 mol/(Lmin)
C.其它条件不变的情况下,加入催化剂可提高CO的转化率
D.若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a=5.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com