
【题目】有机物A、B、C、D的结构简式如图所示。
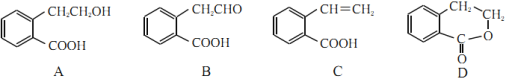
(1)A、B、C中含有的相同官能团名称是___________。
(2)在A、B、C、D中,1mol物质与足量钠反应产生1molH2的是___________(填字母)。
(3)A→B的反应类型是___________;A、B、C、D中互为同分异构体的是___________(填字母)。
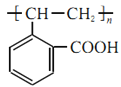
(4)A发生缩聚反应的产物的结构简式为___________;C发生加聚反应的产物的结构简式为___________。
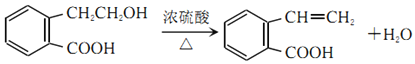
(5)写出由A→C的化学方程式___________。
【答案】羧基 A 氧化反应 C和D 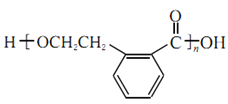
【解析】
(1)根据各物质结构简式推知各官能团名称;
(2)能与钠反应产生H2的官能团有羟基、羧基;
(3)A→B的转化完成了醇羟基转化为醛基,属于氧化反应;分子式相同,但结构不同的物质互为同分异构体;
(4)A通过羧基与羟基的酯化发生缩聚反应;C含有碳碳双键,可发生加聚反应;
(5)A发生消去反应生成C。
(1)由结构简式可知A中含有的官能团为羧基和羟基、B中含有的官能团为醛基和羧基、C中含有的官能团为碳碳双键和羧基,故A、B、C中含有的相同官能团名称是羧基;
(2)能与钠反应产生H2的官能团有羟基、羧基;在A、B、C、D中,1mol物质与足量钠反应产生H2的物质的量分别为1mol、0.5mol、0.5mol、0,故答案为A;
(3)A→B的转化完成了醇羟基转化为醛基,反应的化学方程式为2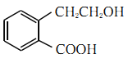 +O2
+O2![]() 2
2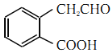 +2H2O,属于氧化反应;C和D分子式相同,但结构不同,C和D互为同分异构体;
+2H2O,属于氧化反应;C和D分子式相同,但结构不同,C和D互为同分异构体;
(4)A通过羧基与羟基的酯化发生缩聚反应,反应的方程式为n
![]()
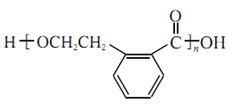 +(n-1)H2O,产物的结构简式为
+(n-1)H2O,产物的结构简式为 ;C含有碳碳双键,可发生加聚反应,反应的方程式为n
;C含有碳碳双键,可发生加聚反应,反应的方程式为n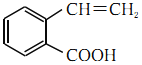
![]()
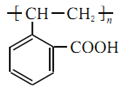 ,故C发生加聚反应的产物的结构简式为
,故C发生加聚反应的产物的结构简式为 ;
;
(5)A发生消去反应生成C,由A→C的化学方程式为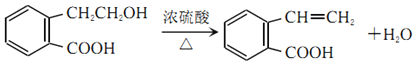 。
。


科目:高中化学 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如图:
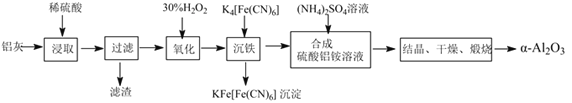
(1)铝灰中氧化铝与硫酸反应的化学方程式为___。
(2)图中“滤渣”的主要成分为___(填化学式)。加30%的H2O2溶液发生的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为___。
(4)煅烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过如图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过如图所示的装置。

①集气瓶中收集到的气体是___(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有__(填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示,主要步骤如下:

步骤1:三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3:反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤,得到三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤,得到三乙醚合溴化镁,加热至160℃分解得到无水MgBr2产品。
已知:
①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。
回答下列问题:
(1)装置中无水氯化钙的作用是___。实验中不能用干燥的空气代替干燥的N2,原因是___。
(2)如将装置B改为装置C,可能会导致的后果是___。
(3)装置中使用球形冷凝管的目的是___。
(4)步骤4中用苯溶解粗品,除去产品中的___杂质。
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式为Mg2++Y4-=MgY2-。
①滴定前润洗滴定管的操作方法是___。
②测定前,选称取0.2500g无水MgBr2产品,溶解后,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是___(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:

(1)实验室制取氨气的化学方程式是____。
(2)如图一是进行氨气喷泉实验的装置,引发喷泉后氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)____。
(3)该小组同学设计了如图二所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式___。
②碱石灰的作用是________。
③该装置存在明显缺陷,请指出存在的问题______。
Ⅱ.3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO![]() 为_____ mol。
为_____ mol。
②所生成的NO在标准状况下体积为_______L。(以上结果均用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物经李比希法测得其中含碳为54.5%、含氢为9.1%,其余为氧。用质谱法分析得知该有机物的相对分子质量为88。请回答下列有关问题:
(1)该有机物的分子式为___________.
(2)若该有机物在水溶液中呈酸性,且结构中不含支链,则其核磁共振氢谱峰面积之比为___________;该物质与乙酸相比,在水中的溶解度大的是___________(填名称),理由是___________。
(3)实验测得该物质不发生银镜反应,利用红外光谱仪测得该有机物分子的红外光谱如下图所示。

①该有机物的结构简式可能是___________、___________(写出两种即可)。
②写出其中一种与NaOH溶液反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(?) ![]() zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
A. 各物质的计量数一定满足:x+y=z
B. 若B为气体,压缩后B的体积分数增大,转化率降低
C. 无论B为固体或气体,压缩后B的质量都不会改变
D. 压缩时,平衡向逆反应方向移动,且正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用如图装置模拟在A池中实现铁上镀铜,在C装置中实现工业KCl制取KOH溶液。
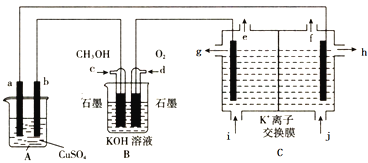
下列有关说法错误的是
A. a为精铜,b为铁制品可实现镀铜要求
B. c为负极,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O
C. 从e出来的气体为氧气,从f出来的气体为氢气
D. 钾离子从电解槽左室向右室迁移,h口出来的为高浓度的KOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com