
【题目】下列各组互为同系物的是
A. 氧气和臭氧 B. 氢原子和氘原子 C. 乙醇和甲醇 D. 正丁烷和异丁烷
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
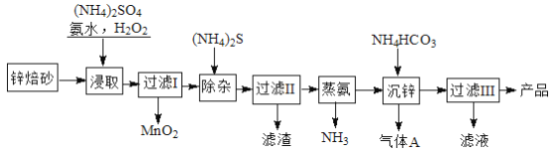
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42-)时,溶液呈___________ (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是__________________(任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为____________________________。
(4)“沉锌”的离子方程式为__________________________________。
(5)“过滤III”所得滤液可循环使用,其主要成分的化学式是__________________。
(6)己知:HCN的电离常数Ka=4.9×10 -10, H2S 的电离常数Ka1=1.3×10 -7,Ka2=7.0×10 -15,向NaCN 溶液中通入少量的H2S 气体,反应的离子方程式为______________________________________。在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.0×10 -4molL-1时,Mn2+开始沉淀,则a=____________。[已知: Ksp(MnS)=1.4×10 -15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度(T℃)下的溶液中,c(H+)=10﹣x molL﹣1 , c(OH﹣)=10﹣y molL﹣1 , x与y的关系如图所示,请回答下列问题: 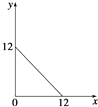
(1)此温度下,水的离子积Kw为 , 则该温度T25(填“>”、“<”或“=”).
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示.
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a= , 实验②中由水电离产生的c(OH﹣)=molL﹣1.
(3)在此温度下,将0.1molL﹣1的NaHSO4溶液与0.1molL﹣1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1molL﹣1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1molL﹣1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显(填“酸”、“碱”或“中”)性.
②写出按乙方式混合后,反应的离子方程式: .
③按甲方式混合后,所得溶液的pH为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基态原子的核外电子排布为4d105s1的元素应在( )
A.s区、第五周期、ⅠA族B.ds区、第五周期、ⅠB族
C.d区、第四周期、ⅠB族D.ds区、第五周期、ⅠA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为__________________。
(2)利用如图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________________处。
②若X为锌,开关K置于M处,该电化学防护法称为__________。
(3)图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量____3.2 g(填“<”“>”或“=”)。
(4)图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是______________________,若将开关K置于N处,发生的总反应是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究H2O2制备氧气,生成氧气速率的影响因素,某同学设计了如下一系列实验。
实验编号 | 反应物 | 催化剂 |
甲 | 试管中加入3 mL 2% H2O2溶液和3滴蒸馏水 | 无 |
乙 | 试管中加入3 mL 5% H2O2溶液和3滴蒸馏水 | 无 |
丙 | 试管中加入3 mL 5% H2O2溶液和3滴蒸馏水 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
丁 | 试管中加入3 mL 5% H2O2溶液和3滴稀盐酸溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
戊 | 试管中加入3 mL 5% H2O2溶液和3滴NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
[查阅资料] 过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气。研究表明,将新制的5%的H2O2溶液加热到65 ℃时就有氧气放出,加热到80 ℃时就有较多氧气产生。
(1)实验丙、实验丁和实验戊的实验目的是_____________________________________。
(2)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的?______
(3)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
①对实验丁,20~40 s的反应速率v1=_____mL·s-1,100~120 s的反应速率v2=_____mL·s-1。不考虑实验测量误差,二者速率存在差异的主要原因是_____________________________________。
②如图是根据实验收集到最大体积的气体时所用时间绘制的图像。曲线c表示的是实验 ______(填“丙”“丁”或“戊”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应中化合价降低的物质是还原剂
B.有氧元素参加的反应一定是氧化还原反应
C.反应前后元素化合价没有变化的反应一定不是氧化还原反应
D.氧化剂在反应中被氧化,还原剂在反应中被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com