
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
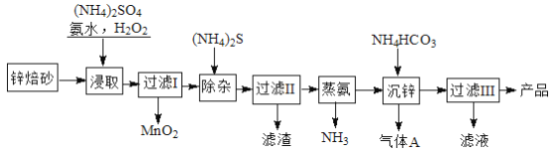
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42-)时,溶液呈___________ (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是__________________(任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为____________________________。
(4)“沉锌”的离子方程式为__________________________________。
(5)“过滤III”所得滤液可循环使用,其主要成分的化学式是__________________。
(6)己知:HCN的电离常数Ka=4.9×10 -10, H2S 的电离常数Ka1=1.3×10 -7,Ka2=7.0×10 -15,向NaCN 溶液中通入少量的H2S 气体,反应的离子方程式为______________________________________。在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.0×10 -4molL-1时,Mn2+开始沉淀,则a=____________。[已知: Ksp(MnS)=1.4×10 -15]
【答案】 中 适当加热、粉碎锌焙砂、搅拌等 Mn2++H2O2+2NH3·H2O= MnO2↓+2NH4++2H2O 3Zn2++6HCO3-=2Zn(OH)2·ZnCO3↓+ 5CO2↑+ H2O (NH4)2SO4 CN-+H2S=HCN+HS- 5
【解析】制备2Zn(OH)2·ZnCO3流程为:以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料中加入硫酸铵、氨水、双氧水,双氧水将锰离子氧化成二氧化锰,过滤后在滤液中加硫化铵,再过滤,除去铜离子,蒸氨除去多余的氨气,加入碳酸氢铵得到2Zn(OH)2·ZnCO3和二氧化碳气体,过滤得2Zn(OH)2·ZnCO3,滤液为硫酸铵溶液。
(1)(NH4)2SO4与NH3·H2O的混合溶液中存在电荷守恒:c (NH4+)+c(H+)=2c(SO42-)+c(OH-),25℃,c(NH4+)=2c(SO42-)时,c(H+)=c(OH-),pH=7是显中性的溶液。
(2)根据影响反应速率的因素判断“浸取”时为了提高锌的浸出率,可采取的措施为搅拌、适当加热,粉碎锌焙砂等。(3)“浸取”时加入的NH3·H2O过量,溶液呈碱性,双氧水将锰离子氧化成MnO2,反应的离子方程式为Mn2++H2O2+2NH3·H2O=MnO2↓+2NH4++2H2O,(4)“沉锌”的过程为溶液中的锌离子与碳酸氢铵溶液反应生成2Zn(OH)2·ZnCO3,“沉锌”的离子方程式为:3Zn2++6HCO3-=2Zn(OH)2·ZnCO3↓+5CO2↑+H2O ;(5)“过滤3”所得滤液为硫酸铵溶液,可循环使用,其化学式为 (NH4)2SO4 。(6)己知:HCN的电离常数Ka=4.9×10 -10, H2S的电离常数Ka1=1.3×10 -7,Ka2=7.0×10 -15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为CN-+H2S=HCN+HS-。当Qc=Ksp(MnS)时开始沉淀,调节溶液的pH=a,H2S电离常数:Ka2=7.0×10 -15,HS-浓度为1.0×10 -4molL-1时,则Ka2=![]() ,则7.0×10 -15=
,则7.0×10 -15=![]() ,则c(S2-)=7×10a-19molL-1,所以Ksp=c(Mn2+)·c(S2-)=7×10a-19molL-1×0.020molL-1=1.4×10-15,解得a=5。
,则c(S2-)=7×10a-19molL-1,所以Ksp=c(Mn2+)·c(S2-)=7×10a-19molL-1×0.020molL-1=1.4×10-15,解得a=5。


科目:高中化学 来源: 题型:
【题目】利用下列装置和操作不能达到实验目的的是( )
|
|
|
|
A.从含碘CCl4溶液中提取碘和回收CCl4溶剂 | B.萃取操作过程中的放气 | C.定量测定化学反应速率 | D.比较KMnO4、Cl2、S的氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示. 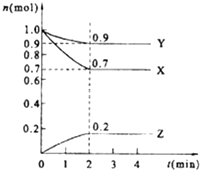
(1)由图中所给数据进行分析,该反应的化学方程式为;
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=;
(3)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足: n (X)=n (Y)=n (Z),则原混合气体中a:b= .
(4)下列措施能加快反应速率的是(多选).
A.恒压时充入He
B.恒容时充入He
C.恒容时充入X
D.及时分离出Z
E.升高温度
F.选择高效的催化剂
(5)下列说法正确的是(单选).
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度是不可能改变的
D.增大Y的浓度,正反应速率加快,逆反应速率减慢.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图判断,下列说法正确的是( )

A. 装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-Fe2+
B. 装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-4OH-
C. 装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D. 放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解池中的溶液。己知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
2PbSO4(s)+2H2O(l)电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )

A. d极为阴极
B. 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-=PbSO4(s)+2H2O(l)
C. 若利用甲池精炼铜,b极应为粗铜
D. 若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com