
����Ŀ��������Ԫ��A��B��C��D��E��Ԫ�����ڱ��е�λ������ͼ��ʾ������BԪ����̼Ԫ�ء���ش���������:
��1��BԪ�������ڱ��е�λ�ã�_________________����д����ԭ�ӵĵ���ʽ��___________����ԭ�Ӻ������������ߵ��ܼ��ǣ�_______��
��2���Ƚ�A��C��DԪ�ؼ����Ӱ뾶�Ĵ�С��_______>_______>_______ (��������)��
��3��F��Dͬ���������ڣ���Ƚ�D���⻯���F���⻯���ȶ��Դ�С��_______ (�û�ѧʽ��ʾ)��
��4��E���ʳ���ʪ��ĵ��۵⻯����ֽ���顣��ѧ���Ե��۵⻯�ؽ�����ʵ��̽�����ڵ��۵⻯����Һ�У��μ���������������Һ�����̻ῴ����Һ����ɫ��������Ϊ_______������������ԭ��Ӧ֪ʶ�������������ͬ���������γɵ���ɫ��Һ�У��ٵμ�����������Һ��������ɫ����ʧ��������Ϊ_________________���ݴ˷�����I2��ClO-��SO42-������������ǿ��˳������Ϊ____________________��
���𰸡� �ڶ�����IVA ![]() 2P N3- O2- Al3+ H2O>H2S NaClO��KI����������I2 I2��Na2SO3��ԭ������I- SO42-< I2-
2P N3- O2- Al3+ H2O>H2S NaClO��KI����������I2 I2��Na2SO3��ԭ������I- SO42-< I2-
��������������Ԫ��A��B��C��D��E,BԪ���γɵĻ���������Ȼ���е��������,��BΪCԪ��,��Ԫ�������ڱ��е�λ�������Ƴ�CΪN,DΪO,AΪAl,EΪCl��
(1) BΪ̼Ԫ�أ��˵����Ϊ6�������ڱ��еڶ����ڵ�IVA��������������ĸ�������������ʽΪ![]() ����������Ų�Ϊ1s22s22p2����ԭ�Ӻ������������ߵ��ܼ���2P����ȷ�𰸣��ڶ�����IVA��
����������Ų�Ϊ1s22s22p2����ԭ�Ӻ������������ߵ��ܼ���2P����ȷ�𰸣��ڶ�����IVA�� ![]() �� 2P��
�� 2P��
(2)A��C��DԪ�ؼ�����:![]() ��
��![]() ��
��![]() ��������ͬ�ĵ����Ų�,��ԭ������������Ӱ뾶С,�������Ӱ뾶Ϊ
��������ͬ�ĵ����Ų�,��ԭ������������Ӱ뾶С,�������Ӱ뾶Ϊ![]() ����ȷ����. N3- �� O2- ��Al3+ ��
����ȷ����. N3- �� O2- ��Al3+ ��
��3��F��Dͬ����������,��FΪS,��ǽ�����![]() ,��O���⻯���S���⻯���ȶ���H2O>H2S ����ȷ���� H2O>H2S��
,��O���⻯���S���⻯���ȶ���H2O>H2S ����ȷ���� H2O>H2S��
��4��NaClO��Һ����ǿ�����ԣ��ܹ��ѵ���������Ϊ�ⵥ�ʣ�����������Һ�������������ƾ��л�ԭ�ԣ��ܹ��ѵԭΪ�����ӣ�����������Ϊ��������ӣ�������ɫ����ʧ���������Ӳ���ʹ������Һ�������������Ϸ�����֪��ClO-�����Դ��ڵ⣬��������Դ�����������ӣ�����I2��ClO-��SO42-������������ǿ��˳������ΪSO42-< I2<ClO-����ȷ�𰸣�NaClO��KI����������I2 �� I2��Na2SO3��ԭ������I- ��SO42-< I2<ClO-��


 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д� Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����������������ʵ�ֵ���
A.KMnO4��K2MnO4B.PCl3��PCl5C.CO2��CO32-D.NO3-��NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2SO2(g)+O2(g)![]() 2SO3(g)+Q kJ��mol-1(Q��0)������˵����ȷ����
2SO3(g)+Q kJ��mol-1(Q��0)������˵����ȷ����
A. ��ͬ�����£�2molSO2(g)��1molO2(g)�����е�����С��2molSO3(g)�����е�����
B. ��2molSO2(g)��1molO2(g)��ַ�Ӧ�ɷų�������ΪQ kJ
C. ����ѹǿ�������¶ȣ���ƽ�ⶼ���淴Ӧ�����ƶ�
D. ����ַ�Ӧ�����Q kJ����˹�������2molSO2(g)������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Է�������Ϊ86����������к���3����CH3��2����CH2����1��![]() ������ϸýṹ������������һ��ȡ�����ܹ��м��֣� ��
������ϸýṹ������������һ��ȡ�����ܹ��м��֣� ��
A. 10�� B. 9�� C. 8�� D. 7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E���ֶ���������Ԫ�أ�ԭ��������A��E������AԪ�������������Ǵ�����������2��������B�������Ӻ�C������������ԭ�ӵĵ��Ӳ�ṹ��ͬ������ͨ��״���£�B�ĵ��������壬0.1molB��������������������ȫ��Ӧ����0.4mol����ת�ƣ���C�ĵ����ڵ�ȼʱ��B�ĵ��ʳ�ַ�Ӧ�����ɵ���ɫ�Ĺ��壬�˵���ɫ��������AB2��Ӧ������B�ĵ��ʣ���D����̬�⻯��������ۺ�������ܷ���������ԭ��Ӧ����д����
��1��AԪ�ص����������ĵ���ʽ _________________________ ��
��2��BԪ�������ڱ��е�λ�� _______________________________ ��
��3��B������C�����ڵ�ȼʱ��Ӧ����������������ѧ�������� ____________________ ��
��4��DԪ�صĵͼ���������E�ĵ��ʵ�ˮ��Һ��Ӧ�Ļ�ѧ����ʽΪ ______________ ��
��5��Ԫ��D��Ԫ��E��ȣ��ǽ����Խ�ǿ���� ______ ����Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ���� _______________ ����ѡ����ţ���
a��������D�ĵ��ʺ�E�ĵ���״̬��ͬ
b��E���⻯���D���⻯���ȶ�
c��һ��������D��E�ĵ��ʶ������Ʒ�Ӧ
d��D����ۺ�������������E����ۺ�����
e��D�ĵ�������E���⻯�ﷴӦ����E���ʣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
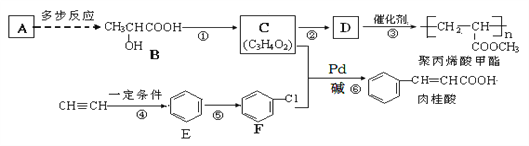
����Ŀ��A(C2H4)�ǻ������л�����ԭ�ϣ���A�Ʊ��۱�ϩ��������л�������Ҫ�ɷ֣��������ĺϳ�·�ߣ����ַ�Ӧ������ȥ������ͼ��ʾ��
��֪:![]() ��XΪ±ԭ�ӣ�RΪȡ������
��XΪ±ԭ�ӣ�RΪȡ������![]()
�ش��������⣺
��1��B�к��������ŵ�������____________����Ӧ�ٵķ�Ӧ������__________________���ķ�Ӧ������_________��![]()
��2�������Ļ�ѧʽΪ_______________����C��ȡD�Ļ�ѧ����ʽΪ__________________________________________��
��3��������ͬ���칹������ͬʱ���������������ٱ�����������ȡ�������ܷ���������Ӧ���۱����������ֲ�ͬ�������⡣��д��һ�ַ�������Ҫ�����ʵĽṹ��ʽ��_______________________________��
��4���������һ���ɱ�ϩ(CH2=CH-CH3)�Ʊ�B�ĺϳ�·�ߣ����Լ���ѡ��___________���ϳ�·�߳��õı�ʾ��ʽΪ��![]()
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�������ȷ����![]()
A. 6.8 g���ڵ�KHS04�к��е�������Ϊ0.15 NA
B. ��״���£�11.2 L�����к��е�̼̼����Ϊ0.5NA
C. N2(g)+3H2(g)=2NH3(g)��H=-92.4 kJ/mol����ת�Ƶĵ�����Ϊ6NAʱ���÷�Ӧ�� �� 92.4 kJ������
D. ���³�ѹ�£�4.4gCO2��N2O��������к��е�ԭ������Ϊ0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ⷨ������ʱ����������������࣬����Ҫ�ɷ�ΪMnO2��Pb���������������������������ͼ�ǻ��յ��������������MnCO3�Ĺ������̡�

��֪��Al(OH)3��Mn(OH)2��MnCO3��Ksp�ֱ�Ϊ1.0��10-33��1.9��10-13��2.2��10-11��
(l)����ԭ�����ʱ��������ΪCO2��������Ӧ�Ļ�ѧ����ʽΪ____��
(2)����ԭ�����ʵ���У��̵Ľ����ʽ����ͼ��ʾ����ͼ��֪�������õ����ʵ������Ϊ ____ ��

(3)��Һl�е���������ɼ��±���
��� | Mn2+ | Fe2+ | Fe3+ | Al3+ |
Ũ��/(mol��L-1) | 0.85 | 2.4��10-3 | 1.0��10-2 | 2.0��10-3 |
�����ӡ�ʱ�ȼ�MnO2��MnO2������Ϊ ___��
�ټӰ�ˮ����pHʹ�������ӳ�����ȫ��ͨ������˵��Al3+������ȫʱMn2+�Ƿ�ʼ���� ___��
(4)�����̡�ʱ������Ӧ�����ӷ���ʽΪ ___��
(5)�����̡��Ĺؼ�������2�㣺�ٽ�NH4HCO3��Һ����MnSO4��Һ�У��ڷ�Ӧ�յ�pH=7������ߵ��Լ��μ�˳��MnSO4��Һ����NH4HCO3����Һ�У���Ӧ�յ�pH>7�������ͬ���ĺ�����ú����____�����з�Ӧ�յ�pH<7�����ܵĺ����______��
(6)����Һ2�л��յõ��ĸ���Ʒ����;Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���֬�͵����ʵ�˵����ȷ����
A. ��������ˮ B. ���Ǹ߷��ӻ�����
C. ������NԪ�� D. ������C��H��O����Ԫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com