
【题目】电解法生产锰时会产生大量的阳极泥,其主要成分为MnO2和Pb,还含有少量其他金属化合物。下图是回收电解锰阳极泥生产MnCO3的工艺流程。

已知:Al(OH)3、Mn(OH)2、MnCO3的Ksp分别为1.0×10-33、1.9×10-13、2.2×10-11。
(l)“还原酸浸”时氧化产物为CO2,发生反应的化学方程式为____。
(2)“还原酸浸”实验中,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为 ____ 。

(3)滤液l中的阳离子组成见下表:
组成 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
浓度/(mol·L-1) | 0.85 | 2.4×10-3 | 1.0×10-2 | 2.0×10-3 |
“除杂”时先加MnO2,MnO2的作用为 ___。
再加氨水调节pH使杂质离子沉淀完全,通过计算说明Al3+沉淀完全时Mn2+是否开始沉淀 ___。
(4)“沉锰”时发生反应的离子方程式为 ___。
(5)“沉锰”的关键操作有2点:①将NH4HCO3溶液滴入MnSO4溶液中;②反应终点pH=7。如果颠倒试剂滴加顺序,将MnSO4溶液滴人NH4HCO3,溶液中,或反应终点pH>7可能造成同样的后果,该后果是____;如粜反应终点pH<7,可能的后果是______。
(6)从滤液2中回收得到的副产品的用途为________。
【答案】 12MnO2+C6H12O6+12H2SO4=12MnSO4+6CO2↑+18H2O 90min,80℃ 将Fe2+氧化为Fe3+ Al3+沉淀完全时,c(OH-)=![]() ,此时,Qsp[Mn(OH)2]=8.5×10-19.6,Qsp[Mn(OH)2]<Ksp[Mn(OH)2],所以Mn(OH)2没有开始沉淀 Mn2++2HCO3-=MnCO3↓+H2O+CO2↑ 可能产生Mn(OH)2沉淀,造成MnCO3纯度降低 MnCO3可能溶解,造成产率降低 作氮肥
,此时,Qsp[Mn(OH)2]=8.5×10-19.6,Qsp[Mn(OH)2]<Ksp[Mn(OH)2],所以Mn(OH)2没有开始沉淀 Mn2++2HCO3-=MnCO3↓+H2O+CO2↑ 可能产生Mn(OH)2沉淀,造成MnCO3纯度降低 MnCO3可能溶解,造成产率降低 作氮肥
【解析】(l)在酸性条件下,二氧化锰能够把葡萄糖氧化为二氧化碳,本身还原为锰离子,反应的化学方程式为:12MnO2+C6H12O6+12H2SO4=12MnSO4+6CO2↑+18H2O;正确答案:12MnO2+C6H12O6+12H2SO4=12MnSO4+6CO2↑+18H2O。
(2) “还原酸浸”实验中,用的时间越短,温度越高,锰的浸出率越高,效果越好;根据图示可知,所采用的最佳实验条件为90min,80℃ ;正确答案:90min,80℃。
(3)根据图表信息可知,MnO2 具有氧化性,“除杂”时先加MnO2,能够把Fe2+氧化为Fe3+,然后调节溶液的pH使铁离子沉淀下来;再加氨水调节pH使杂质离子Al3+沉淀完全,计算过程如下:Al3+沉淀完全时,c(OH-)=![]() ,此时Qsp[Mn(OH)2]=8.5×10-19.6,Qsp[Mn(OH)2]<Ksp[Mn(OH)2],所以Mn(OH)2没有开始沉淀;正确答案:把Fe2+氧化为Fe3+;Al3+沉淀完全时,c(OH-)=
,此时Qsp[Mn(OH)2]=8.5×10-19.6,Qsp[Mn(OH)2]<Ksp[Mn(OH)2],所以Mn(OH)2没有开始沉淀;正确答案:把Fe2+氧化为Fe3+;Al3+沉淀完全时,c(OH-)=![]() ,此时Qsp[Mn(OH)2]=8.5×10-19.6,Qsp[Mn(OH)2]<Ksp[Mn(OH)2],所以Mn(OH)2没有开始沉淀。
,此时Qsp[Mn(OH)2]=8.5×10-19.6,Qsp[Mn(OH)2]<Ksp[Mn(OH)2],所以Mn(OH)2没有开始沉淀。
(4)硫酸锰与碳酸氢铵溶液混合反应生成碳酸锰和二氧化碳,“沉锰”时发生反应的离子方程式为:Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;正确答案:Mn2++2HCO3-=MnCO3↓+H2O+CO2↑。
(5)“沉锰”的关键操作有2点:①将NH4HCO3溶液滴入MnSO4溶液中;②反应终点pH=7。如果颠倒试剂滴加顺序,将MnSO4溶液滴人NH4HCO3,溶液中,或反应终点pH>7可能造成同样的后果,该后果是可能产生Mn(OH)2沉淀,造成MnCO3纯度降低;如果反应终点pH<7,酸性增强,可能的后果是MnCO3可能溶解,造成产率降低;正确答案:可能产生Mn(O)2沉淀,造成MnCO3纯度降低; MnCO3可能溶解,造成产率降低。
(6) “沉锰”过程中除了生成碳酸锰外还有硫酸铵溶液存在于滤液中,回收硫酸铵可以作氮肥;正确答案:作氮肥。


科目:高中化学 来源: 题型:
【题目】Ⅰ.现有三种短周期元素:①H ②Na ③Cl。
(1)氢原子结构示意图______; ②的单质在③的单质中燃烧,生成物是一种_______化合物(填“离子”或“共价”)。
(2)①与③形成的化合物的电子式是_______________,该化合物中含有___________共价键(填“极性”或“非极性”)。
Ⅱ.现有四种烃分子的球棍模型(如图)。
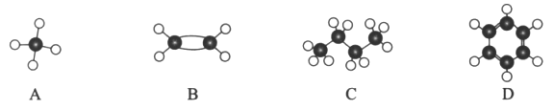
(1)与A互为同系物的是___________(填序号)。
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)。
(3)C的同分异构体的结构简式是_____________________________。
(4)在光照条件下,A与氯气发生反应生成气态有机物的化学反应方程式是:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素是碳元素。请回答下列问题:
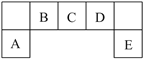
(1)B元素在周期表中的位置:_________________;请写出该原子的电子式:___________;其原子核外电子能量最高的能级是:_______。
(2)比较A、C、D元素简单离子半径的大小:_______>_______>_______ (填微粒符号)。
(3)F与D同主族且相邻,请比较D的氢化物和F的氢化物稳定性大小:_______ (用化学式表示)。
(4)E单质常用湿润的淀粉碘化钾试纸检验。有学生对淀粉碘化钾进行了实验探究。在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立刻会看到溶液变蓝色,这是因为_______(请结合氧化还原反应知识解释相关现象,下同)。在所形成的蓝色溶液中,再滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为_________________。据此分析,I2、ClO-、SO42-氧化性有弱到强的顺序排列为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钙、盐酸是中学化学实验中的常用试剂.
(1)甲同学拟测定CaCO3固体与过量0.1molL﹣1 HCl的反应速率.
①该反应的离子方程式为 .
②设计实验方案:通过测量计算反应速率
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.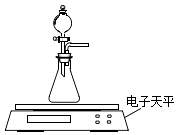
电子天平限选试剂与用品:0.1molL﹣1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①﹣⑥所代表的必要数据或物理量
物理量 | V(0.1molL﹣1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
实验1 | a | b | 0 | c | d | |
实验2 | ① | 0 | ③ | c | d | |
实验3 | c | ② | 0 | ④ | d |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是

![]()
A. a是负极,电池工作时,电子的流动力向是:电极a-负载一电极b-质子膜一电极a
B. 电池工作时,化学能转化为电能和热能
C. 电极b上发生的电极反应式为O2+ 4e-+4H+=2H2O
D. 当电路中通过4mol电子时,有4molH+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏低的是( )
①定容时仰视刻度线②容量瓶用蒸馏水洗涤但没有干燥③没有洗涤溶解NaCl固体的烧杯和玻璃棒④称量NaCl固体时所用砝码生锈了
A.①③B.②③C.①②③D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向碘水中加入适量CCl4并振荡,静置后观察到的现象是( )
A. 形成均匀的无色溶液 B. 形成均匀的紫红色溶液
C. 液体分层,下层呈紫红色 D. 液体分层,上下层均呈无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是
A. 定容时加水加多了,用滴管吸出溶液至刻度线
B. 定容时仰视刻度线
C. 没有洗涤溶解NaCl固体的烧杯和玻璃棒
D. 称量NaCl固体时砝码上有杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com