
【题目】Ⅰ.现有三种短周期元素:①H ②Na ③Cl。
(1)氢原子结构示意图______; ②的单质在③的单质中燃烧,生成物是一种_______化合物(填“离子”或“共价”)。
(2)①与③形成的化合物的电子式是_______________,该化合物中含有___________共价键(填“极性”或“非极性”)。
Ⅱ.现有四种烃分子的球棍模型(如图)。
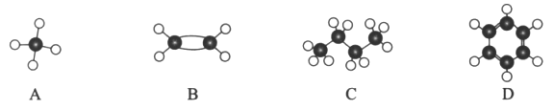
(1)与A互为同系物的是___________(填序号)。
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)。
(3)C的同分异构体的结构简式是_____________________________。
(4)在光照条件下,A与氯气发生反应生成气态有机物的化学反应方程式是:________。
科目:高中化学 来源: 题型:
【题目】下图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:

(1)该反应的化学方程式为_________________。
(2)0~t1s内B气体的平均反应速率为____________。
(3)(t1+10)s时,A的转化率为_____。
(4)关于该反应的说法正确的是_________。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味、遇水反应生成一种氯化物和两种氮化物。某学习小组在实验空用Cl2和NO制备ClNO并测定其纯度,相关实验装置(夹持装置略去)如下图所示。请回答:

(1)制备C12发生装置可以选用____(填写字母代号),请写出发生反应的离子方程式:____________。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→_______(按气流方向,用小写字母表示)。
(3)实验室可用下图装置制备亚硝酰氯(C1NO):
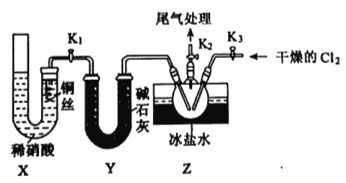
①实验室也可用B装置制备NO,X装置的优点为__________。
②检验装置气密性并装入药品,打开K2,然后再打开K1,通入一段时间气体,其目的为_______,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中C1NO可能发生反应的化学方程式为________。
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmolL-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(C1NO)的质量分数为______(用代数式表示)。[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(K2CrO4)=1×10-12]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
A.N2(g)+3H2(g)2NH3(g);△H=2(b﹣a) kJ/mol
B.N2(g)+3H2(g)2NH3(l);△H=2(a﹣b﹣c) kJ/mol
C.![]() N2(g)+
N2(g)+ ![]() H2(g)NH3(l);△H=(b+c﹣a) kJ/mol
H2(g)NH3(l);△H=(b+c﹣a) kJ/mol
D.![]() N2(g)+
N2(g)+ ![]() H2(g)NH3(g);△H=(a+b) kJ/mol
H2(g)NH3(g);△H=(a+b) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g)+Q kJ·mol-1(Q>0)。下列说法正确的是
2SO3(g)+Q kJ·mol-1(Q>0)。下列说法正确的是
A. 相同条件下,2molSO2(g)和1molO2(g)所具有的能量小于2molSO3(g)所具有的能量
B. 将2molSO2(g)和1molO2(g)充分反应可放出的热量为Q kJ
C. 增大压强或升高温度,该平衡都向逆反应方向移动
D. 若充分反应后放热Q kJ,则此过程中有2molSO2(g)被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个![]() ,则符合该结构的所有烷烃的一氯取代物总共有几种( )
,则符合该结构的所有烷烃的一氯取代物总共有几种( )
A. 10种 B. 9种 C. 8种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法生产锰时会产生大量的阳极泥,其主要成分为MnO2和Pb,还含有少量其他金属化合物。下图是回收电解锰阳极泥生产MnCO3的工艺流程。

已知:Al(OH)3、Mn(OH)2、MnCO3的Ksp分别为1.0×10-33、1.9×10-13、2.2×10-11。
(l)“还原酸浸”时氧化产物为CO2,发生反应的化学方程式为____。
(2)“还原酸浸”实验中,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为 ____ 。

(3)滤液l中的阳离子组成见下表:
组成 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
浓度/(mol·L-1) | 0.85 | 2.4×10-3 | 1.0×10-2 | 2.0×10-3 |
“除杂”时先加MnO2,MnO2的作用为 ___。
再加氨水调节pH使杂质离子沉淀完全,通过计算说明Al3+沉淀完全时Mn2+是否开始沉淀 ___。
(4)“沉锰”时发生反应的离子方程式为 ___。
(5)“沉锰”的关键操作有2点:①将NH4HCO3溶液滴入MnSO4溶液中;②反应终点pH=7。如果颠倒试剂滴加顺序,将MnSO4溶液滴人NH4HCO3,溶液中,或反应终点pH>7可能造成同样的后果,该后果是____;如粜反应终点pH<7,可能的后果是______。
(6)从滤液2中回收得到的副产品的用途为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com