
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏低的是( )
①定容时仰视刻度线②容量瓶用蒸馏水洗涤但没有干燥③没有洗涤溶解NaCl固体的烧杯和玻璃棒④称量NaCl固体时所用砝码生锈了
A.①③B.②③C.①②③D.全部
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g)+Q kJ·mol-1(Q>0)。下列说法正确的是
2SO3(g)+Q kJ·mol-1(Q>0)。下列说法正确的是
A. 相同条件下,2molSO2(g)和1molO2(g)所具有的能量小于2molSO3(g)所具有的能量
B. 将2molSO2(g)和1molO2(g)充分反应可放出的热量为Q kJ
C. 增大压强或升高温度,该平衡都向逆反应方向移动
D. 若充分反应后放热Q kJ,则此过程中有2molSO2(g)被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是![]()
A. 6.8 g熔融的KHS04中含有的离子数为0.15 NA
B. 标准状况下,11.2 L乙酸中含有的碳碳键数为0.5NA
C. N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ/mol,当转移的电子数为6NA时,该反应放 出 92.4 kJ的热量
D. 常温常压下,4.4gCO2和N2O混合气体中含有的原子总数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法生产锰时会产生大量的阳极泥,其主要成分为MnO2和Pb,还含有少量其他金属化合物。下图是回收电解锰阳极泥生产MnCO3的工艺流程。

已知:Al(OH)3、Mn(OH)2、MnCO3的Ksp分别为1.0×10-33、1.9×10-13、2.2×10-11。
(l)“还原酸浸”时氧化产物为CO2,发生反应的化学方程式为____。
(2)“还原酸浸”实验中,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为 ____ 。

(3)滤液l中的阳离子组成见下表:
组成 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
浓度/(mol·L-1) | 0.85 | 2.4×10-3 | 1.0×10-2 | 2.0×10-3 |
“除杂”时先加MnO2,MnO2的作用为 ___。
再加氨水调节pH使杂质离子沉淀完全,通过计算说明Al3+沉淀完全时Mn2+是否开始沉淀 ___。
(4)“沉锰”时发生反应的离子方程式为 ___。
(5)“沉锰”的关键操作有2点:①将NH4HCO3溶液滴入MnSO4溶液中;②反应终点pH=7。如果颠倒试剂滴加顺序,将MnSO4溶液滴人NH4HCO3,溶液中,或反应终点pH>7可能造成同样的后果,该后果是____;如粜反应终点pH<7,可能的后果是______。
(6)从滤液2中回收得到的副产品的用途为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组变化中,化学反应的△H前者小于后者的一组是( )
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1;CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2;
②S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)═SO2(g)△H2;
③2H2(g)+O2(g)═2H2O(l)△H1;H2(g)+ ![]() O2(g)═H2O(l)△H2;
O2(g)═H2O(l)△H2;
④CaCO3(s)═CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)═Ca(OH)2(s)△H2 .
A.①②
B.②③
C.①③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r的溶液是一种一元强酸,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )
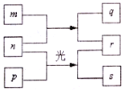
A. 原子半径的大小W<X<Y B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态 D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。
(2)B中质子数和中子数相等的核素符号为____,E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是______L(标准状况下)。
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠具有强氧化性,遇木炭、铝粉等还原性物质时可燃烧.下列有关说法不正确的是( )
A.Na2O2与CO2反应时,Na2O2是氧化剂,CO2是还原剂
B.1mol过氧化钠中阴离子数目为1NA
C.过氧化钠与木炭、铝粉反应时,过氧化钠均表现出强氧化性
D.过氧化钠与二氧化硫反应时可生成硫酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com