
【题目】依据叙述,写出下列反应的热化学方程式:
(1)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为______________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________________________________。
【答案】N2(g)+2O2(g)=2NO2(g) ΔH=+67.8 kJ·mol-1C2H2(g)+ ![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1N 2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1N 2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ·mol-1
【解析】
根据反应热和燃烧热的定义计算出相关的热量,同时注意物质的状态,再书写相应的热化学方程式即可。
(1)适量的N2和O2完全反应,每生成23克NO2即0.5molNO2要吸收16.95kJ热量,所以每生成2molNO2需要吸收67.8kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=+67.8kJmol-1;
(2)依据反应2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)可知,每2mol乙炔参加反应,转移20mol电子,现有5NA个电子转移时,放出650kJ的热量,则1mol乙炔反应时可放出1300kJ的热量,所以此反应燃烧热的热化学方程式为C2H2(g)+ ![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1;
O2(g)=2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1;
(3)在反应N2+3H22NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJmol-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】研究人员研制出一种可作为鱼雷和潜艇的储备电源的新型电池——锂水电池(结构如图),使用时加入水即可放电。下列关于该电池的说法不正确的是( )
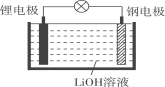
A. 锂为负极,钢为正极B. 工作时负极的电极反应式为Li-e-=Li+
C. 工作时OH-向钢电极移动D. 放电时电子的流向:锂电极→导线→钢电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式_____________________。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:___________________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_____________________________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下等质量的SO2和CO2相比较,下列各项正确的是( )
A. 原子个数之比为1:1B. 物质的量之比为1:1
C. 体积之比为11:16D. 分子数之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO、CuS、少量FeS和SiO2)中回收铍和铜两种金属的流程。

已知:Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]、=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=2.l×10-13
(1)写出铍铜元件中SiO2与NaOH溶液反应的离子方程式______________________。
(2)滤渣B的主要成分为___________________(填化学式)。写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式___________________________________________。
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序________。
a.加入过量的NaOH b.过滤 c.加入适量的HCl
d.加入过量的氨水 e.通入过量的CO2 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是___________________________________。
(4)MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式________________________________。
(5)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中能大量共存的是( )
A.K+、OH-、H+B.Na+、Ca2+、CO32-
C.Na+、SO42-、Cl-D.Al3+、NO3-、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨为电极分别电解硫酸钠溶液和饱和食盐水,关于两个电解池反应的说法正确的是( )
A. 阳极反应式相同
B. 电解结束后所得液体的pH相同
C. 阴极反应式相同
D. 通过相同电量时生成的气体总体积相等(同温同压)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,破坏了共价键
C.CH3CH2CH2OH和CH3CH2OCH3互为同分异构体
D.加热氧化镁使之熔化克服的是共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com