
【题目】下列实验中①配制一定物质的量浓度的溶液;②pH试纸的使用;③过滤;④蒸发。都要用到的仪器是
A.玻璃棒B.烧杯C.蒸发皿D.酒精灯
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质,按氧化物、混合物、单质、电解质顺序排列的是 ( )
A.二氧化硫、碘酒、液态臭氧、烧碱B.硫酸钾、纯碱、白磷、生石灰
C.氧化铜、氯化氢、钠、干冰D.氧化钙、胆矾、氮气、空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(该还原菌最佳生存环境在pH为7~8之间)作用下,能被 SO42-腐蚀,其电化学腐蚀原理如下图所示, 写出正极的电极反应式__________。

(2)在1800K时
2Fe(s)+3/2O2(g)=Fe2O3(s) △H1=-354.2kJ/mol
3Fe(s)+O2(g)=Fe3O4(s) △H2=-550.9kJ/mol
则反应:2Fe3O4(s)+1/2O2(g)=3Fe2O3(s) 的△H 为____kJ/mol
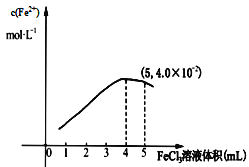
(3)Fe3+和I-在水溶液中的反应如下:2I-+ 2Fe3+![]() 2Fe2+ +I2(在水溶液中)。298K 时,向 5mL0.1mol/L的 KI 溶液中滴加 0.1 mol/L FeCl3 溶液,得到 c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:该温度下滴加 5mLFeCl3溶液时,Fe3+的平衡转化率 =____ %, 平衡常数 K=_____
2Fe2+ +I2(在水溶液中)。298K 时,向 5mL0.1mol/L的 KI 溶液中滴加 0.1 mol/L FeCl3 溶液,得到 c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:该温度下滴加 5mLFeCl3溶液时,Fe3+的平衡转化率 =____ %, 平衡常数 K=_____
(4)在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
该温度下,若向同容积的另一容器中投的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正________(填大于小于等于v逆。由上表中的实验数据计算得到浓度-时间的关系可用下图中的曲线表示,表示c(N2)-t的曲线是____________。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,下列说法错误的是 ( )
A. Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
B. 工业生产玻璃、水泥,均需要用石灰石为原料
C. 将二氧化硫添加于红酒中可以起到杀菌和抗氧化作用
D. 纳米铁粉和FeS都可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其原理是相同的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及的离子方程式 |
A | c(OH-)c(H+)=1酸性溶液中 | Fe2+、NO3-、Al3+、CO32- | 不能大量共存,3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
B | 由水电离出c(H+) =1×10-13mol·L-1 | K+、NH4+、Cl-、[Al(OH)4]- | 能大量共存 |
C | 有大量Fe3+的溶液 | Na+、NH4+、SO42-、Cl- | 能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
(1)装置A中反应的化学方程式是________.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是 ______。

(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中,向第1支试管中滴加适量氨水出现白色沉淀___________(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是______。
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有___ 性.
(5)装置D的作用是______。
(6)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样.并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验.请计算该空气中SO2的体积分数(用含V的代数式表示)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据叙述,写出下列反应的热化学方程式:
(1)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为______________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气(含烃类、CO、NO和SO2等)是空气的主要污染源。治理方法之一是在汽车排气管上加装“催化转化器”,使CO和NO反应产生可参与大气循环的无毒气体,促使烃类充分燃烧及SO2的转化。下列说法中错误的是( )
A. CO和NO反应生成CO2和N2反应方程式为2CO+2NO![]() 2CO2+N2
2CO2+N2
B. 汽车改用天然气为燃料或开发氢能源,都可减少对空气的污染
C. 此方法的缺点是由于CO2的增多,会大大提高空气的酸度
D. 增大绿化面积,多植树造林,可有效控制城市空气污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com