
【题目】按要求回答下列问题:
(1)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(该还原菌最佳生存环境在pH为7~8之间)作用下,能被 SO42-腐蚀,其电化学腐蚀原理如下图所示, 写出正极的电极反应式__________。

(2)在1800K时
2Fe(s)+3/2O2(g)=Fe2O3(s) △H1=-354.2kJ/mol
3Fe(s)+O2(g)=Fe3O4(s) △H2=-550.9kJ/mol
则反应:2Fe3O4(s)+1/2O2(g)=3Fe2O3(s) 的△H 为____kJ/mol
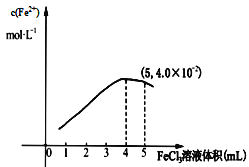
(3)Fe3+和I-在水溶液中的反应如下:2I-+ 2Fe3+![]() 2Fe2+ +I2(在水溶液中)。298K 时,向 5mL0.1mol/L的 KI 溶液中滴加 0.1 mol/L FeCl3 溶液,得到 c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:该温度下滴加 5mLFeCl3溶液时,Fe3+的平衡转化率 =____ %, 平衡常数 K=_____
2Fe2+ +I2(在水溶液中)。298K 时,向 5mL0.1mol/L的 KI 溶液中滴加 0.1 mol/L FeCl3 溶液,得到 c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:该温度下滴加 5mLFeCl3溶液时,Fe3+的平衡转化率 =____ %, 平衡常数 K=_____
(4)在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
该温度下,若向同容积的另一容器中投的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正________(填大于小于等于v逆。由上表中的实验数据计算得到浓度-时间的关系可用下图中的曲线表示,表示c(N2)-t的曲线是____________。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________________________。

【答案】SO42-+5H2O+8e-=HS-+9OH- +39.2 80 3200 大于 乙 B
【解析】
(1)由图示分析,正极是硫酸根离子发生还原反应,生成硫氢根离子;
(2)结合已知反应,根据盖斯定律计算反应热;
(3) 由图示可知,平衡时c(Fe2+)=4.0![]() 10-2mol/L,
10-2mol/L,
则Fe3+的平衡转化率 =![]() 100%=80%;
100%=80%;
平衡时2I-+ 2Fe3+![]() 2Fe2+ +I2平衡常数 K=
2Fe2+ +I2平衡常数 K=![]() =
=![]() =3200;
=3200;
(4)①由表可以知道表可以知道25min反应达平衡状态,
N2(g)+3H2(g)2NH3(g),
起始(mol/L)2 6 0
变化(mol/L) 1 3 2
平衡(mol/L) 1 3 2
此时平衡常数为:K=![]() =
=![]() ,根据Qc与K的大小平衡判断正逆反应速率的大小;
,根据Qc与K的大小平衡判断正逆反应速率的大小;
②由反应方程式可以知道:N2(g)+3H2(g)2NH3(g)变化量之比等于对应物质的化学计量数之比,而![]() n甲:
n甲:![]() n乙:
n乙:![]() n丙=3:1:2,所以表示c(N2)~t的曲线是乙;在此温度下,若起始充入4 mol N2和12 mol H2,相当于在原来基础上增加压强,平衡正向移动,所以比原平衡的两倍小,而且达平衡的时间缩短,由此分析解答。
n丙=3:1:2,所以表示c(N2)~t的曲线是乙;在此温度下,若起始充入4 mol N2和12 mol H2,相当于在原来基础上增加压强,平衡正向移动,所以比原平衡的两倍小,而且达平衡的时间缩短,由此分析解答。
(1)根据图示。正极得电子,发生还原反应,生成硫氢根离子,所以电极反应式为:SO42-+5H2O+8e-=HS-+9OH-;
故答案为:SO42-+5H2O+8e-=HS-+9OH-;
(2)①2Fe(s)+3/2O2(g)=Fe2O3(s) △H1=-354.2kJ/mol
②3Fe(s)+O2(g)=Fe3O4(s) △H2=-550.9kJ/mol
依据盖斯定律①×3-②×2得到:
2Fe3O4(s)+1/2O2(g)=3Fe2O3(s) △H=3![]() (-354.2kJ/mol)-2
(-354.2kJ/mol)-2![]() (-550.9kJ/mol)=+39.2kJ/mol;
(-550.9kJ/mol)=+39.2kJ/mol;
故答案为:+39.2;
(3)由图示可知,平衡时c(Fe2+)=4.0![]() 10-2mol/L,
10-2mol/L,
则Fe3+的平衡转化率 =![]() 100%=80%;
100%=80%;
平衡时2I-+ 2Fe3+![]() 2Fe2+ +I2平衡常数 K=
2Fe2+ +I2平衡常数 K=![]() =
=![]() =3200;
=3200;
故答案为:80 ;3200;
(4) ①由表可以知道表可以知道25min反应达平衡状态,
N2(g)+3H2(g)2NH3(g),
起始(mol/L)2 6 0
变化(mol/L) 1 3 2
平衡(mol/L) 1 3 2
此时平衡常数为:K=![]() =
=![]() ,根据Qc=
,根据Qc=![]() =
=![]() <K,所以平衡正向移动,即此时v正大于v逆,故答案为:大于;
<K,所以平衡正向移动,即此时v正大于v逆,故答案为:大于;
②由反应方程式可以知道:N2(g)+3H2(g)2NH3(g)变化量之比等于对应物质的化学计量数之比,而![]() n(甲):
n(甲):![]() n(乙):
n(乙):![]() n(丙)=3:1:2,所以表示c(N2)~t的曲线是乙;在此温度下,若起始充入4 mol N2和12 mol H2,相当于在原来基础上增加压强,平衡正向移动,所以比原平衡的两倍小,而且达平衡的时间缩短,则应是点B,
n(丙)=3:1:2,所以表示c(N2)~t的曲线是乙;在此温度下,若起始充入4 mol N2和12 mol H2,相当于在原来基础上增加压强,平衡正向移动,所以比原平衡的两倍小,而且达平衡的时间缩短,则应是点B,
故答案为:乙;B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在2 L密闭容器内,反应2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
(1)用NO2表示0~2 s内该反应的平均速度___________.在第5 s时,NO2的转化率为_____。根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是_____________________。
(2)上述反应在第3 s后达到平衡,能说明该反应已达到平衡状态的是______。
a.单位时间内,消耗2 mol NO2的同时生成1 mol的N2O4
b.容器内压强保持不变
c.v逆(NO2)=2v正(N2O4)
d.容器内密度保持不变
(3)在2 s内,该反应_______(“吸收”或“放出”) _______热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制出一种可作为鱼雷和潜艇的储备电源的新型电池——锂水电池(结构如图),使用时加入水即可放电。下列关于该电池的说法不正确的是( )
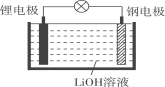
A. 锂为负极,钢为正极B. 工作时负极的电极反应式为Li-e-=Li+
C. 工作时OH-向钢电极移动D. 放电时电子的流向:锂电极→导线→钢电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构简式为:___________________________
(2)写出B、D化合物中官能团(写化学式):
B中含官能团________________;D中含官能团_____________;
(3)写出反应的化学方程式
①:___________________________________________反应类型:___________________
②:___________________________________________ 反应类型:____________________
③:___________________________________________ 反应类型:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将25.6gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.4mol,这些气体恰好能被500mL 1mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为( )
A. 0.2molB. 0.1molC. 0.4molD. 0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Fe+2HCl=FeCl2+ H2↑反应,下列说法不正确的是( )
A.Fe是还原剂,被氧化
B.HCl是氧化剂,发生了还原反应
C.-1价氯在反应中价态未变,所以HCl既不是氧化剂,又不是还原剂
D.此反应既是置换反应又是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式_____________________。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:___________________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_____________________________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨为电极分别电解硫酸钠溶液和饱和食盐水,关于两个电解池反应的说法正确的是( )
A. 阳极反应式相同
B. 电解结束后所得液体的pH相同
C. 阴极反应式相同
D. 通过相同电量时生成的气体总体积相等(同温同压)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com