
【题目】一定条件下,在2 L密闭容器内,反应2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
(1)用NO2表示0~2 s内该反应的平均速度___________.在第5 s时,NO2的转化率为_____。根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是_____________________。
(2)上述反应在第3 s后达到平衡,能说明该反应已达到平衡状态的是______。
a.单位时间内,消耗2 mol NO2的同时生成1 mol的N2O4
b.容器内压强保持不变
c.v逆(NO2)=2v正(N2O4)
d.容器内密度保持不变
(3)在2 s内,该反应_______(“吸收”或“放出”) _______热量。
【答案】0.0075 molL-1s-187.5%随着反应的进行,二氧化氮的物质的量浓度减小bc放出2.7 kJ
【解析】
(1)用NO2表示0~2s内该反应的平均速度v=![]() =0.0075mol/(L·s);第3s时该反应已经达到平衡状态,达到平衡状态时参加反应的n(NO2)=(0.040-0.005)mol=0.035mol,NO2的转化率=0.035mol/0.040mol×100%=87.5%;反应速率与物质的量浓度成正比,随着反应的进行,二氧化氮的物质的量浓度减小,反应速率降低;(2)a.单位时间内,无论反应是否达到平衡状态,都存在消耗2molNO2的同时生成1mol的N2O4,不能据此判断平衡状态,a错误;b.反应前后气体体积改变,所以当容器内压强保持不变,正逆反应速率相等,该反应达到平衡状态,b正确;c.当v逆(NO2)=2v正(N2O4)=v正(NO2),该反应达到平衡状态,c正确;d.无论反应是否达到平衡状态,容器内密度始终保持不变,不能据此判断平衡状态,d错误;答案选bc;(3)该反应的正反应是放热反应,所以二氧化氮转化为四氧化二氮时放出热量,参加反应的二氧化氮0.030mol,放出的热量=0.030mol/2mol×180kJ=2.7kJ。
=0.0075mol/(L·s);第3s时该反应已经达到平衡状态,达到平衡状态时参加反应的n(NO2)=(0.040-0.005)mol=0.035mol,NO2的转化率=0.035mol/0.040mol×100%=87.5%;反应速率与物质的量浓度成正比,随着反应的进行,二氧化氮的物质的量浓度减小,反应速率降低;(2)a.单位时间内,无论反应是否达到平衡状态,都存在消耗2molNO2的同时生成1mol的N2O4,不能据此判断平衡状态,a错误;b.反应前后气体体积改变,所以当容器内压强保持不变,正逆反应速率相等,该反应达到平衡状态,b正确;c.当v逆(NO2)=2v正(N2O4)=v正(NO2),该反应达到平衡状态,c正确;d.无论反应是否达到平衡状态,容器内密度始终保持不变,不能据此判断平衡状态,d错误;答案选bc;(3)该反应的正反应是放热反应,所以二氧化氮转化为四氧化二氮时放出热量,参加反应的二氧化氮0.030mol,放出的热量=0.030mol/2mol×180kJ=2.7kJ。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大,已知A的L层电子数是K层电子数的两倍,D是短周期元素中原子半径最大的元素,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素名称:A______;B______;E______;
(2)元素E在周期表中的位置_________,B、C、D、E的原子半径由小到大的顺序为(用元素符号或化学式表示,以下同)____________,D2C2的电子式__________,所含化学键____________.
(3)写出![]() 与
与![]() 反应的化学方程式_______________________.
反应的化学方程式_______________________.
(4)C、E的简单氢化物的沸点较高的是_____________,原因是________________.
(5)用电子式表示化合物D2E的形成过程______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
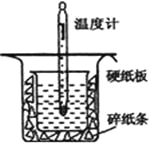
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________,除此之外,装置中的一个明显错误是 ______________________。
(2)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量_________________(填“相等”、“不相等”),若实验操作均正确,则所求中和热_________________(填“相等”“不相等”)。
(3)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3和SiO2,还含有少量的FeO、Fe2O3等)为原料制备Al2O3的流程如下:

(1)“酸浸”时需加入过量的稀硫酸,目的是提高浸取率和________;滤渣的主要成分是__________。
(2)“氧化”过程中,加入H2O2发生反应的离子方程式为____________。
(3)“提纯”过程中,当加入NaOH溶液达到沉淀量最大时,溶液中c(SO42-)∶c(Na+)=_________。
(4)已知Ksp[Fe(OH)3]=1×10-39。“提纯”过程中,当c(Fe3+)<10-6 mol ·L-1时,溶液中c(OH-)>________mol ·L-1。
(5)“沉淀”过程中,通入过量CO2时发生反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A. 2v(NH3)=v(CO2) B. 密闭容器中混合气体的密度不变
C. 密闭容器中氨气的体积分数不变 D. 密闭容器中c(NH3)∶c(CO2)=2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(该还原菌最佳生存环境在pH为7~8之间)作用下,能被 SO42-腐蚀,其电化学腐蚀原理如下图所示, 写出正极的电极反应式__________。

(2)在1800K时
2Fe(s)+3/2O2(g)=Fe2O3(s) △H1=-354.2kJ/mol
3Fe(s)+O2(g)=Fe3O4(s) △H2=-550.9kJ/mol
则反应:2Fe3O4(s)+1/2O2(g)=3Fe2O3(s) 的△H 为____kJ/mol
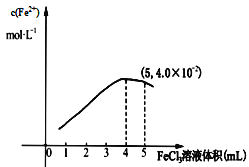
(3)Fe3+和I-在水溶液中的反应如下:2I-+ 2Fe3+![]() 2Fe2+ +I2(在水溶液中)。298K 时,向 5mL0.1mol/L的 KI 溶液中滴加 0.1 mol/L FeCl3 溶液,得到 c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:该温度下滴加 5mLFeCl3溶液时,Fe3+的平衡转化率 =____ %, 平衡常数 K=_____
2Fe2+ +I2(在水溶液中)。298K 时,向 5mL0.1mol/L的 KI 溶液中滴加 0.1 mol/L FeCl3 溶液,得到 c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:该温度下滴加 5mLFeCl3溶液时,Fe3+的平衡转化率 =____ %, 平衡常数 K=_____
(4)在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
该温度下,若向同容积的另一容器中投的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正________(填大于小于等于v逆。由上表中的实验数据计算得到浓度-时间的关系可用下图中的曲线表示,表示c(N2)-t的曲线是____________。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com