
����Ŀ���к��ȵIJⶨ�Ǹ�����Ҫ�Ķ���ʵ�顣ȡ0��55mol/L��NaOH��Һ50mL��0��25mol/L������50mL����ͼ��ʾ��װ���н����к��ȵIJⶨʵ�飬�ش��������⣺
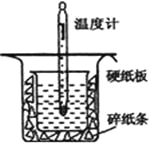
��1������ͼʵ��װ�ÿ���������ȱ�ٵ�һ�ֲ�����Ʒ��_________������֮�⣬װ���е�һ�����Դ����� ______________________��
��2��������60mL 0��25mol��L-1 H2SO4��50mL 0��55mol��L-1NaOH��Һ���з�Ӧ������ʵ����ȣ����ų�������_________________����������������������������ʵ���������ȷ���������к���_________________������������������������
��3��ʵ���������±���
������д�±��еĿհף�
�¶� ʵ����� | ��ʼ�¶�t1�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ ��t2��t1��/�� | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26��2 | 26��0 | 26��1 | 29��5 | ___________ |
2 | 27��0 | 27��4 | 27��2 | 32��3 | |
3 | 25��9 | 25��9 | 25��9 | 29��2 | |
4 | 26��4 | 26��2 | 26��3 | 29��8 | |
�ڽ�����Ϊ0��55 mol/L NaOH��Һ��0��25 mol/L������Һ���ܶȶ���1 g/cm3���кͺ�������Һ�ı�����c��4��18 J/��g�����������к�����H��__________ �� ȡС�����һλ����
���𰸡����β��������С�ձ���δ��Ӳֽ���ס������ձ�����ֽ�������ˣ�δ��С�ձ�����㹻�ߣ���������3��4-56��8kJ/mol
��������
��1����������װ��ͼ��ȱ�ٵ������ǻ��β��������������֮���Ǵ�С�ձ��ڣ�δ��ͬһˮƽ�棬��С�ձ���δ��Ӳֽ���ס����ձ�����ֽ�������ˣ�δ��С�ձ�����㹻������2������60mL 0��25mol��L-1 H2SO4��50mL 0��55mol��L-1NaOH��Һ�����ķ�Ӧ������ʵ�����ͬ����ų���������ȣ��к�����ϡ���ϡ�Ӧ����1molH2Oʱ�ų����������뷴Ӧ������Ķ�����ϵ����������к�����ȣ���3�����²�ֱ���3.4��5.1��3.3��3.5����2���²���������ȣ����̫����2����ֵ���ԣ����ƽ���²�Ϊ![]() =3.4���ڡ�H=��
=3.4���ڡ�H=��![]() kJ��mol��1=��56.8kJ��mol��1��
kJ��mol��1=��56.8kJ��mol��1��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݱ������ݣ��Ʋ���Ԫ�ص�ԭ�Ӱ뾶�����ǣ� ��
Ԫ�� | N | S | O | Si |
ԭ�Ӱ뾶/(10-10m) | 0.75 | 1.02 | 0.73 | 1.11 |
A.0.80��10-10mB.1.10��10-10m
C.1.20��10-10mD.0.70��10-10m
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���ij�ܱ������з�����Ӧ��2HI(g)![]() H2(g)��I2(g)����H>0����15s��c(HI)��0.1mol��L��1����0.07mol��L��1��������˵����ȷ����(��)
H2(g)��I2(g)����H>0����15s��c(HI)��0.1mol��L��1����0.07mol��L��1��������˵����ȷ����(��)
A. 0��15 s����I2��ʾ��ƽ����Ӧ����Ϊv(I2)��0.002 mol��L��1��s��1
B. c(HI)��0.07 mol��L��1����0.05 mol��L��1����ķ�Ӧʱ��С��10 s
C. �����¶�����Ӧ���ʼӿ죬�淴Ӧ���ʼ���
D. ��С��Ӧ��ϵ���������ѧ��Ӧ���ʼӿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ǻ���һ�����һ�������ˮƽ����Ҫ��־����������������У���ؼ���һ����ӦΪ��2SO2(g)+O2(g)![]() 2SO3(g)��
2SO3(g)��
��1��һ�������£�SO2��O2��Ӧ10 min����SO2��SO3���ʵ���Ũ�ȷֱ�Ϊ0.1 mol/L��0.3 mol/L����10 min������SO3�Ļ�ѧ��Ӧ����Ϊ___________��SO2��ת����Ϊ___________��
��2�����й��ڸ÷�Ӧ��˵����ȷ����_________��
A������O2��Ũ���ܼӿ췴Ӧ���� B��������ϵ�¶��ܼӿ췴Ӧ����
C��ʹ�ô����ܼӿ췴Ӧ���� D��һ�������´ﵽ��Ӧ��ʱSO2ȫ��ת��ΪSO3
��3���ڷ�Ӧ��������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2 mol/L��0.1 mol/L��0.2 mol/L������Ӧ�ﵽƽ��ʱ�����ܴ��ڵ�������______��
A��O2Ϊ0.2 mol/L B��SO2Ϊ0.25 mol/L
C��SO3Ϊ0.4 mol/L D��SO2��SO3��Ϊ0.15 mol/L
��4����ҵ�����ᣬ�ù����İ�ˮ��SO2β����������д����صĻ�ѧ����ʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ����ʱ��Ӧʹ�¶ȼ�ˮ�������Һ����
B. ��Һʱ����Һ©�����²�Һ����¿ڷų����ϲ�Һ����Ͽڵ���
C. �ᡢ���������ڵ���ʣ����������ﶼ�Ƿǵ����
D. ��ˮ�ĵ����Ժܲ�,����ˮ���ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���2 L�ܱ������ڣ���Ӧ2NO2(g)![]() N2O4(g) ��H����180 kJ��mol��1��n(NO2)��ʱ��仯���±���
N2O4(g) ��H����180 kJ��mol��1��n(NO2)��ʱ��仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
��1����NO2��ʾ0��2 s�ڸ÷�Ӧ��ƽ���ٶ�___________���ڵ�5 sʱ��NO2��ת����Ϊ_____�������ϱ����Կ��������ŷ�Ӧ���У���Ӧ������С����ԭ����_____________________��
��2��������Ӧ�ڵ�3 s��ﵽƽ�⣬��˵���÷�Ӧ�Ѵﵽƽ��״̬����______��
a����λʱ���ڣ�����2 mol NO2��ͬʱ����1 mol��N2O4
b��������ѹǿ���ֲ���
c��v��(NO2)��2v��(N2O4)
d���������ܶȱ��ֲ���
��3����2 s�ڣ��÷�Ӧ_______���������������ų����� _______������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Լ�ȩ�ͱ���Ϊ��Ҫԭ��������ͼ��ʾϵ��ת���ɺϳɷ�ȩ��֬����Ҫ�л��ϳ� �м��� D(���ַ�Ӧ�����Ͳ�����ȥ)��

(1)CH3OH ������Ϊ_____��
(2)C �����������ŵ�������_____��
(3)��Ӧ�ڵĻ�ѧ����ʽ��_____��
(4)���й��� A ���������ܷ�ӳ֧���Ա����ṹ����Ӱ�����_____(����ĸ)��
a����������������Һ��Ӧ b����ʹ���Ը��������Һ��ɫ c��ϡ��Һ�м�Ũ��ˮ��������
(5)E(C8H10O2)�� B ��ˮ����ﻥΪͬ���칹����1 mol E ���� 2 mol NaOH ��Ӧ����˴Ź���������ʾ�� 3 �ַ��ҷ����֮��Ϊ 3��1��1������������ E ����_____�֡�
(6) ��������� CH3OH �� CH3ONa Ϊ ԭ �� ( �� �� �� �� �� �� �� ѡ ) �� �� �� �� ��CH3COCH2COOCH3 �ĺϳ�·�ߡ� CH3OH�D�D������ ___________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A�����2 mol B�������2 L���ܱ������У�һ�������·������·�Ӧ��2A(g)+B(g)![]() 2C(g)������2 s����C��Ũ��Ϊ0.6 mol/L�����м���˵����ȷ����
2C(g)������2 s����C��Ũ��Ϊ0.6 mol/L�����м���˵����ȷ����
��������A��ʾ�ķ�Ӧƽ������Ϊ0.3 mol/(L��s)
��������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.6 mol/(L��s)
��2 sʱ����A��ת����Ϊ70%
��2 sʱ����B��Ũ��Ϊ0.7 mol/L
A. �٢� B. �٢� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25.6gCu��ȫ��������Ũ�����У��ռ��������������NO��N2O4��NO2���Ļ���ﹲ0.4mol����Щ����ǡ���ܱ�500mL 1mol/LNaOH��Һ��ȫ���գ����ɺ�NaNO3��NaNO2������Һ������NaNO3�����ʵ���Ϊ�� ��
A. 0.2molB. 0.1molC. 0.4molD. 0.3mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com