
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构简式为:___________________________
(2)写出B、D化合物中官能团(写化学式):
B中含官能团________________;D中含官能团_____________;
(3)写出反应的化学方程式
①:___________________________________________反应类型:___________________
②:___________________________________________ 反应类型:____________________
③:___________________________________________ 反应类型:________________
【答案】CH2 = CH2- OH- COOHCH2=CH2+H2O![]() CH3CH2OH加成反应2CH3CH2OH+O2
CH3CH2OH加成反应2CH3CH2OH+O2![]() 2CH3CHO+2H2O氧化反应CH3CH2OH+CH3COOH
2CH3CHO+2H2O氧化反应CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O酯化反应或取代反应
CH3COOCH2CH3+H2O酯化反应或取代反应
【解析】
(1)乙烯的分子式为C2H4,其结构简式为CH2=CH2;(2)乙烯与H2O发生加成反应,生成乙醇,即B的结构简式为CH3CH2OH,B中含有的官能团是-OH,反应③发生酯化反应,生成乙酸乙酯,D为乙酸,结构简式为CH3COOH,含有的官能团是-COOH;(3)反应①:乙烯与H2O发生加成反应,反应方程式为CH2=CH2+H2O![]() CH3CH2OH;反应②:发生氧化反应,反应方程式为2CH3CH2OH+O2
CH3CH2OH;反应②:发生氧化反应,反应方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;反应③:发生酯化反应或取代反应,反应方程式为CH3CH2OH+CH3COOH
2CH3CHO+2H2O;反应③:发生酯化反应或取代反应,反应方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。


科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A. 2v(NH3)=v(CO2) B. 密闭容器中混合气体的密度不变
C. 密闭容器中氨气的体积分数不变 D. 密闭容器中c(NH3)∶c(CO2)=2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1。请回答下列问题:
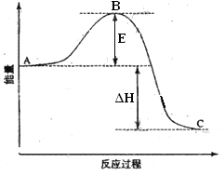
(1)图中A、C分别表示________、_________,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是_________________________。
(2)图中△H=____________kJ·mol-1。
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=_________υ(SO3)=___________。
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按氧化物、混合物、单质、电解质顺序排列的是 ( )
A.二氧化硫、碘酒、液态臭氧、烧碱B.硫酸钾、纯碱、白磷、生石灰
C.氧化铜、氯化氢、钠、干冰D.氧化钙、胆矾、氮气、空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到目的的是( )
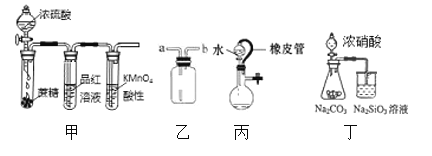
A. 用甲装置验证浓H2SO4的脱水性、强氧化性
B. 用乙装置收集NO气体
C. 装置丙中水能持续流下,说明装置气密性不良好
D. 用丁装置比较N、C、Si非金属性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(该还原菌最佳生存环境在pH为7~8之间)作用下,能被 SO42-腐蚀,其电化学腐蚀原理如下图所示, 写出正极的电极反应式__________。

(2)在1800K时
2Fe(s)+3/2O2(g)=Fe2O3(s) △H1=-354.2kJ/mol
3Fe(s)+O2(g)=Fe3O4(s) △H2=-550.9kJ/mol
则反应:2Fe3O4(s)+1/2O2(g)=3Fe2O3(s) 的△H 为____kJ/mol
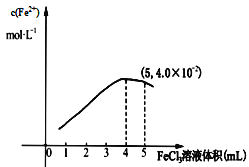
(3)Fe3+和I-在水溶液中的反应如下:2I-+ 2Fe3+![]() 2Fe2+ +I2(在水溶液中)。298K 时,向 5mL0.1mol/L的 KI 溶液中滴加 0.1 mol/L FeCl3 溶液,得到 c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:该温度下滴加 5mLFeCl3溶液时,Fe3+的平衡转化率 =____ %, 平衡常数 K=_____
2Fe2+ +I2(在水溶液中)。298K 时,向 5mL0.1mol/L的 KI 溶液中滴加 0.1 mol/L FeCl3 溶液,得到 c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:该温度下滴加 5mLFeCl3溶液时,Fe3+的平衡转化率 =____ %, 平衡常数 K=_____
(4)在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
该温度下,若向同容积的另一容器中投的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正________(填大于小于等于v逆。由上表中的实验数据计算得到浓度-时间的关系可用下图中的曲线表示,表示c(N2)-t的曲线是____________。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及的离子方程式 |
A | c(OH-)c(H+)=1酸性溶液中 | Fe2+、NO3-、Al3+、CO32- | 不能大量共存,3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
B | 由水电离出c(H+) =1×10-13mol·L-1 | K+、NH4+、Cl-、[Al(OH)4]- | 能大量共存 |
C | 有大量Fe3+的溶液 | Na+、NH4+、SO42-、Cl- | 能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是

A. 产生气体体积①=②
B. ①中阴极质量增加,②中正极质量减小
C. 溶液的pH变化:①减小,②增大
D. 电极反应式①中阳极:4OH-- 4e-= 2H2O+O2↑,②中负极:2H++2e-=H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com