
����Ŀ��2SO2(g)+O2(g)��2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2(g)����Ϊ1mol SO3�� ��H=��99kJ��mol-1����ش��������⣺
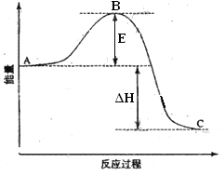
��1��ͼ��A��C�ֱ��ʾ________��_________��E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ������Ӱ�죿_______���÷�Ӧͨ����V2O5����������V2O5��ʹͼ��B�������ǽ��ͣ�_________��������_________________________��
��2��ͼ����H=____________kJ��mol-1��
��3�������Ӧ�����ԣ�SO2��Ϊ0.05 mol��L-1��min-1�����ԣ�O2��=_________��(SO3)=___________��
��4����֪�������ȼ����Ϊ296 kJ��mol-1��������S(s)����3 molSO3(g)����H��Ҫ��д��������̣�_______��
���𰸡���Ӧ�������� ������������ ��Ӱ�� ���� �����ı䷴Ӧ����,���ͻ�� E��198 0.025 mol��L-1��min-1 0.05 mol��L-1��min-1 ��H=��1185kJ/mol
��������
��1������ͼʾ��ͼ��A��ʾ��Ӧ��������C��ʾ������������E��ʾ��Ӧ�Ļ�ܣ���Ӧ��ֻ�뷴Ӧ����������������������Դ�С�йأ������أ�E�Ĵ�С�Է�Ӧ����Ӱ�졣V2O5���������ı䷴Ӧ���̣����ͷ�Ӧ�Ļ��E���Ӷ�ʹͼ��B�㽵�͡�
��2��1 mol SO2��g������Ϊ1 mol SO3��g������H����99 kJ/mol����Ӧ2SO2��g����O2��g��![]() 2SO3��g����H=��198kJ/mol����ͼ����H=��198kJ/mol��
2SO3��g����H=��198kJ/mol����ͼ����H=��198kJ/mol��
��3������ͬһ��Ӧ�в�ͬ���ʱ�ʾ�Ļ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȿ�֪������O2��=0.5����SO2��=0.025mol/��L��min��������SO3��=����SO2��=0.05mol/��L��min����
��4���������ȼ����Ϊ296 kJ/mol�����ʾSȼ���ȵ��Ȼ�ѧ����ʽΪ�٣�S��s��+O2��g��=SO2��g����H=��296kJ/mol������Ϊ�ڣ�2SO2��g����O2��g��![]() 2SO3��g����H=��198kJ/mol��Ӧ�ø�˹���ɿ�֪��+�ڡ�0.5�ã�S��s��+3/2O2��g��=SO3��g����H=����296kJ/mol��+0.5������198kJ/mol��=��395kJ/mol���������3molSO3��g������H=����395kJ/mol����3=��1185kJ/mol��
2SO3��g����H=��198kJ/mol��Ӧ�ø�˹���ɿ�֪��+�ڡ�0.5�ã�S��s��+3/2O2��g��=SO3��g����H=����296kJ/mol��+0.5������198kJ/mol��=��395kJ/mol���������3molSO3��g������H=����395kJ/mol����3=��1185kJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�������Ľṹ��ʽΪ �����й��ڸû������˵������ȷ����
�����й��ڸû������˵������ȷ����
A. ���л���ķ���ʽΪC23H24O6
B. 1mol�û�������������9molH2�����ӳɷ�Ӧ
C. �ȿ���ʹ������Ȼ�̼��Һ��ɫ���ֿ���ʹ����KMnO4��Һ��ɫ
D. �ȿ�����FeCl3��Һ������ɫ��Ӧ���ֿ�����Na2CO3��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ���йط�Ӧ�ʱ���ж���ȷ������ ��
C(s)��O2(g)��CO2(g)����H1 CO2(g)��C(s)��2CO(g)����H2 2CO(g)��O2(g)��2CO2(g)����H3
4Fe(s)��3O2(g)��2Fe2O3(s)����H4 3CO(g)��Fe2O3(s)��3CO2(g)��2Fe(s)����H5
A. ��H1>0����H3<0 B. ��H2>0����H4>0
C. ��H1����H2����H3 D. ��H3����H4����H5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5�֣���50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ�

�ش��������⣺
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ�� ��
��2���ձ���������ֽ���������� ��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ (����ƫ��ƫС����Ӱ����)
��4�������60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������� (������ȡ��������)�������к��� (������ȡ��������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���Ա���Ƴ�һ�ֿ���Ϊ����DZͧ�Ĵ�����Դ�����͵�ء����ˮ���(�ṹ��ͼ)��ʹ��ʱ����ˮ���ɷŵ硣���й��ڸõ�ص�˵������ȷ����(����)
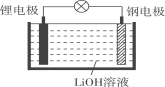
A. �Ϊ��������Ϊ����B. ����ʱ�����ĵ缫��ӦʽΪLi��e����Li��
C. ����ʱOH����ֵ缫�ƶ�D. �ŵ�ʱ���ӵ�����﮵缫�����ߡ��ֵ缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±����Ǹ��鷴Ӧ�ķ�Ӧ��ͷ�Ӧ�¶ȣ���Ӧ�տ�ʼʱ���ų�H2���������ǣ�������
��� | ��������ĩ״�� | ���ʵ�����mol�� | ���Ũ�ȼ���� | ��Ӧ�¶ȣ��棩 |
A | Al | 0.1 | 2mol.L-1����10mL | 60 |
B | Fe | 0.1 | 1mol.L-1����10mL | 50 |
C | Mg | 0.1 | 1mol.L-1����10mL | 60 |
D | Mg | 0.1 | 1mol.L-1����10mL | 60 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ϩ�ܷ�������ת����

��1����ϩ�Ľṹ��ʽΪ��___________________________
��2��д��B��D�������й����ţ�д��ѧʽ����
B�������________________��D�������_____________��
��3��д����Ӧ�Ļ�ѧ����ʽ
�٣�___________________________________________��Ӧ���ͣ�___________________
�ڣ�___________________________________________ ��Ӧ���ͣ�____________________
�ۣ�___________________________________________ ����Ӧ���ͣ�________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Fe+2HCl��FeCl2+ H2����Ӧ������˵������ȷ���ǣ� ��
A��Fe�ǻ�ԭ����������
B��HCl���������������˻�ԭ��Ӧ
C��-1�����ڷ�Ӧ�м�̬δ�䣬����HCl�Ȳ������������ֲ��ǻ�ԭ��
D���˷�Ӧ�����û���Ӧ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ����ѧ����ѧ�ۺ��������õĺϽ𣬹㷺Ӧ�������������Ԫ���������Ǵ�ij�Ͼ���ͭԪ��(��BeO��CuS������FeS��SiO2)�л������ͭ���ֽ��������̡�

��֪�����롢��Ԫ�ش������ڱ��еĶԽ���λ�ã���ѧ��������
�����£�Ksp[Cu(OH)2]��=2.2��10��20��Ksp[Fe(OH)3]=4.0��10��38��Ksp[Mn(OH)2]=2.l��10��13
(1)д����ͭԪ����SiO2��NaOH��Һ��Ӧ�����ӷ���ʽ______________________��
(2)����B����Ҫ�ɷ�Ϊ___________________(�ѧʽ)��д����Ӧ���к��뻯������������ᷴӦ�Ļ�ѧ����ʽ___________________________________________��
(3)����ҺC�к�NaCl��BeCl2������HCl��Ϊ�ᴿBeCl2��ѡ��������貢����________��
a�����������NaOH b������ c������������HCl
d����������İ�ˮ e��ͨ�������CO2 f��ϴ��
�ڴ�BeCl2��Һ�еõ�BeCl2����IJ�����___________________________________��
(4)MnO2�ܽ����������е���Ԫ������Ϊ������д����Ӧ����CuS������Ӧ�����ӷ���ʽ________________________________��
(5)��ҺD�к�c(Cu2+)=2.2mol��L��1��c(Fe3+)=0.008mol��L��1��c(Mn2+)=0.01mol��L��1����μ���ϡ��ˮ����pH�����η��룬���ȳ�������___________(�����ӷ���)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com