
【题目】已知下列热化学方程式,有关反应焓变的判断正确的是( )
C(s)+O2(g)=CO2(g) ΔH1 CO2(g)+C(s)=2CO(g) ΔH2 2CO(g)+O2(g)=2CO2(g) ΔH3
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH4 3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) ΔH5
A. ΔH1>0,ΔH3<0 B. ΔH2>0,ΔH4>0
C. ΔH1=ΔH2+ΔH3 D. ΔH3=ΔH4+ΔH5
【答案】C
【解析】
A、发光放热的剧烈的氧化还原反应为燃烧,故煤炭的燃烧为放热反应,即△H1<0,△H3<0,A错误;
B、以碳、CO或H2为还原剂的氧化还原反应为吸热反应,故△H2>0;燃烧均为放热反应,故铁在氧气中燃烧是放热的,即△H4<0,B错误;
C、一个反应无论是一步完成还是分为几步完成,其热效应是相同的,已知
②CO2(g)+C(s)=2CO(g) △H2
③2CO(g)+O2(g)=2CO2(g) △H3
根据盖斯定律可知将②+③相加可得:C(s)+O2(g)=CO2(g)△H1=△H2 +△H3,C正确;
D、已知:
④4Fe(s)+3O2(g)=2Fe2O3(s) △H4
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
根据盖斯定律可知将(④÷2+⑤)×2/3可得:2CO(g)+O2(g)=2CO2(g)△H3=![]() ,D错误。
,D错误。
答案选C。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子最外层电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化(O、F除外)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3和SiO2,还含有少量的FeO、Fe2O3等)为原料制备Al2O3的流程如下:

(1)“酸浸”时需加入过量的稀硫酸,目的是提高浸取率和________;滤渣的主要成分是__________。
(2)“氧化”过程中,加入H2O2发生反应的离子方程式为____________。
(3)“提纯”过程中,当加入NaOH溶液达到沉淀量最大时,溶液中c(SO42-)∶c(Na+)=_________。
(4)已知Ksp[Fe(OH)3]=1×10-39。“提纯”过程中,当c(Fe3+)<10-6 mol ·L-1时,溶液中c(OH-)>________mol ·L-1。
(5)“沉淀”过程中,通入过量CO2时发生反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A. 2v(NH3)=v(CO2) B. 密闭容器中混合气体的密度不变
C. 密闭容器中氨气的体积分数不变 D. 密闭容器中c(NH3)∶c(CO2)=2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1。请回答下列问题:
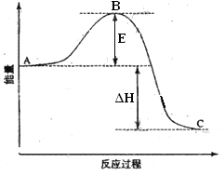
(1)图中A、C分别表示________、_________,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是_________________________。
(2)图中△H=____________kJ·mol-1。
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=_________υ(SO3)=___________。
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及的离子方程式 |
A | c(OH-)c(H+)=1酸性溶液中 | Fe2+、NO3-、Al3+、CO32- | 不能大量共存,3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
B | 由水电离出c(H+) =1×10-13mol·L-1 | K+、NH4+、Cl-、[Al(OH)4]- | 能大量共存 |
C | 有大量Fe3+的溶液 | Na+、NH4+、SO42-、Cl- | 能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com