
| A�����ʵ���Ũ����ȵ�(NH4)2SO4��(NH4)2SO3��Һ�У�NH4+Ũ�ȣ�ǰ�ߴ��ں��� |
| B�������ʵ���Ũ�ȵ�CH3COONa��NaOH��Һ�У���������Ũ�ȣ�ǰ�ߴ��ں��� |
| C������ˮ�������Ϻ�������Һ�п��ܴ��ڣ�c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D����һ����CO2ͨ��NaOH��Һ��������Һ��һ�����ڣ� c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1a/(a+b) | B��0.1b/(a+b) | C��1��107 | D��1��10-7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 �Ĵ���μӵ�
�Ĵ���μӵ� ���ռ���Һ�У����н�����ȷ����
���ռ���Һ�У����н�����ȷ����A���������Һ�� ��������Һ�� ��������Һ�� |
B���������Һ�� ��������Һ�� ��������Һ�� |
C���� ���һ����Һ ���һ����Һ ������� ������� |
D���� �� �� ��������Һ�� ��������Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH��7 | B��pH�� 7 | C��pH��7 | D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��25��ʱNH4Cl��Һ��KW����100��ʱNH4Cl��Һ��KW |
| B��SO2ͨ���ˮ�У���Ӧ�����ӷ���ʽΪSO2��I2��2H2O=SO32����2I�� |
| C�����������ܲ�����������Һ�У����ܴ��ڴ�����Na����Ba2����AlO2����NO3�� |
| D��100��ʱ����pH��2��������pH��12��NaOH��Һ�������ϣ���Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��Ư��֯�������������Һ�п�����
��Ư��֯�������������Һ�п�����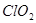 ��
�� ��
��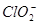 ������
������ ��Ư������Ч�ɷ֣�
��Ư������Ч�ɷ֣�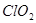 ���ж����塣����ֺ�����pH�仯��ͼ��ʾ����ͼ��֪��ʹ�ø�Ư�������pHΪ
���ж����塣����ֺ�����pH�仯��ͼ��ʾ����ͼ��֪��ʹ�ø�Ư�������pHΪ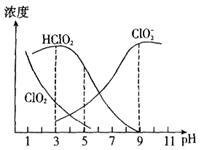
| A��3.0 | B��4.0~4.5 | C��6.5~7.0 | D��9.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pHֵΪ7����Һһ�������� |
| B���������ϵ��ʱ��ͨ���Դ��ƽ�����ƷΪ�������ԶƲ����Ϊ������ |
| C������Ӧ��Ũ�ȣ�������λ�������ӵ���Ŀ���Ӷ�ʹ��Ӧ�������� |
| D��pH��3�������pH��11�İ�ˮ��Һ�����ʵ�Ũ�Ⱥ͵�����������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3COO- + H+
CH3COO- + H+�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com