
【题目】将二氧化硫通入显红色的酚酞试液中,发现红色消失,主要原因是( )
A.二氧化硫具有漂白性B.二氧化硫具有还原性
C.二氧化硫具有氧化性D.二氧化硫溶于水后生成酸
科目:高中化学 来源: 题型:
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10﹣5 | Ka1=4.30×10﹣7 Ka2=5.61×10﹣11 | Ka1=1.54×10﹣2 Ka2=1.02×10﹣7 |
(1)写出碳酸的第一步电离平衡常数表达式:Ka1=__.
(2)在相同条件下,试比较H2CO3、HCO3﹣和HSO3﹣的酸性强弱:__>__>__.
(3)如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化图象中:

①曲线I表示的酸是__(填化学式).
②A、B、C三点中,水的电离程度最大的是__(填字母).
(4)下列事实不能说明醋酸是弱酸的是_______
①当温度低于16.6℃时醋酸可凝结成冰一样晶体
②0.1mol/L的醋酸钠溶液的pH约为9
③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多
④0.1mol/L的醋酸的pH约为4.8
⑤pH都等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸消耗碱液多
⑥同物质的量浓度的醋酸和盐酸加水稀释至pH相同时,醋酸加入的水多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气有下列反应:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
(1)该反应中氧化剂是_____;被还原的元素是_______;氧化产物是 ______;
(2)用单线桥法标出电子转移的方向和数目______________;
(3)若该反应中有0.2mol的电子转移,则能生成标准状况下的氯气的体积是_______;
(4)若该反应有1molKMnO4参加反应,被氧化的HCl为______mol,转移电子数______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25 g·mL-1,质量分数36.5%的浓盐酸配制 0.1 mol·L-1的盐酸240 mL,请回答下列问题:
(1)浓盐酸的物质的量浓度为________。
(2)配制240 mL 0.1 mol·L-1的盐酸应选用________mL的容量瓶,需要浓盐酸体积为_____mL。
(3)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视刻度线,浓度 ____________ ;
②容量瓶未干燥,浓度 __________ ;
③定容摇匀后发现溶液凹面低于刻度线,加水至刻度线,浓度 ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于基本营养物质的说法正确的是( )。
A.所有蛋白质均可通过颜色反应来鉴别
B.糖类、蛋白质、油脂都属于天然高分子化合物
C.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
D.油脂在酸性条件下水解为丙三醇和高级脂肪酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯贝特( )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下:

提示:Ⅰ.图中部分反应条件及部分反应物、生成物已略去。
Ⅱ.
Ⅲ.![]()
⑴氯贝特的分子式为 。
⑵若8.8 g A与足量NaHCO3溶液反应生成2.24 L CO2(标准状况),且B的核磁共振氢谱有两个峰,则A的结构简式为 。(相对原子质量:H-1、C-12、O-16)
⑶要实现反应①所示的转化,加入下列物质不能达到目的的是 (填选项字母)。
a.Na b.NaOH c.NaHCO3 d.CH3COONa
⑷反应②的反应类型为 ,其产物甲有多种同分异构体,同时满足以下条件的所有甲的同分异构体有 种(不考虑立体异构)。
① 1,3,5-三取代苯;
② 属于酯类且既能与FeCl3溶液显紫色,又能发生银镜反应;
③ 1 mol该同分异构体最多能与3 mol NaOH反应。
⑸写出B与足量NaOH溶液反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2 (g) +CO (g) ![]() CH3OH (g)达到平衡。下列说法正确的是
CH3OH (g)达到平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度/mol.L-l | 物质的平衡浓度/mol.L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的逆反应放热
B. 达到平衡时,容器I中反应物转化率比容器II中的大
C. 达到平衡时,容器II中c(H2)大于容器III中c(H2)的两倍
D. 达到平衡时,容器III中的正反应速率比容器I中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑦七种元素在周期表中的位置。

请按要求回答:
(1)七种元素中,原子半径最大的是(填元素符号)_________。
(2)③与⑦的气态氢化物中,稳定性较强的是(填化学式)_________。
(3)元素⑥的最高价氧化物对应的水化物是(填化学式)_________。
(4)由①、②、③三种元素组成的离子化合物是_________,检验该化合物中阳离子的方法是_________。
(5)含有上述元素的物质间存在以下转化。
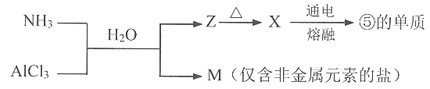
M所含的化学键类型是_________。X生成⑤的单质的化学方程式是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com