
����Ŀ����֪��25��ʱ�����ᡢ̼���������ĵ���ƽ�ⳣ�����±���
���� | ̼�� | ������ |
Ka=1.75��10��5 | Ka1=4.30��10��7 Ka2=5.61��10��11 | Ka1=1.54��10��2 Ka2=1.02��10��7 |
��1��д��̼��ĵ�һ������ƽ�ⳣ������ʽ��Ka1=__��
��2������ͬ�����£��ԱȽ�H2CO3��HCO3����HSO3��������ǿ����__��__��__��
��3����ͼ��ʾ����ʱϡ�ʹ��ᡢ̼���������ϡ��Һʱ����ҺpH��ˮ���ı仯ͼ���У�

������I��ʾ������__���ѧʽ����
��A��B��C�����У�ˮ�ĵ���̶�������__������ĸ����
��4��������ʵ����˵���������������_______
�ٵ��¶ȵ���16.6��ʱ���������ɱ�һ������
��0.1mol/L�Ĵ�������Һ��pHԼΪ9
�۵���������ʵ���Ũ�ȵ�����ȴ��������������ƶ�
��0.1mol/L�Ĵ����pHԼΪ4.8
��pH������4�ҵ�����Ĵ�������ᣬ���Ũ��NaOH��Һ��ַ�Ӧʱ���������ļ�Һ��
��ͬ���ʵ���Ũ�ȵĴ���������ˮϡ����pH��ͬʱ����������ˮ��
���𰸡� c��H+��c��HCO3-��/c��H2CO3�� H2CO3 HSO3- HCO3- CH3COOH C �٢�
��������������Ҫ��������ĵ���ƽ�⡣
��1��̼��ĵ�һ������ƽ�ⳣ������ʽ��Ka1= c��H+��c��HCO3-��/c��H2CO3����
��2������ͬ�����£�̼���Ka1>�������Ka2>̼���Ka2������H2CO3>HSO3->HCO3-��
��3��������I��pH����Һ����仯��������������I��ʾ����������CH3COOH��
��A��B��C�����У�ˮ�ĵ���̶����������������ļ�pH����C��
��4���ٴ�����۵�������Ƿ�����û�й�ϵ���ʢٲ���˵������������ڴ�������Һ�ʼ��ԣ�˵��������ˮ�⣬���������ᣬ�ʢ���˵�������������˵�������Ԫ�����ڴ��ᣬ������Ƿ�����û�й�ϵ���ʢ۲���˵���������������������ǿ�ᣬ��0.1mol/L�����pH=1���ʢ���˵�������������˵���������̶ȱ��Ȼ���С���ʢ���˵����������������pH����Һ����仯�������ʢ�˵�����������ᣬ��ѡ�٢���


 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д� Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֱ��������ʣ���FeCl3 ��KMnO4 ��NaCl ��Ca(HCO3)2 ��Na2SO3 ��K2SO4Ͷ��ˮ�У����������ж�����Һ�����������գ��ܵõ�ԭ���ʵ����� ��
A. �ڢ� B. �ۢ� C. �٢� D. �ݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���о�SO2�����ʶԸ��ƿ�������������Ҫ���塣ij��ѧ��ȤС��Ϊ̽��SO2�Ļ�ѧ���ʽ�������ʵ�飬����ͼװ�ã����ȼ��̶�װ������ȥ����

������ʵ���У�����SO2���������Ե�ʵ������Ϊ____________����Ӧ��ѧ����ʽΪ_____________________��
�� Dװ�õ�������__________��д����װ���з��������ӷ���ʽ______________��
�� A�з�Ӧ��ʼ���Թ�B��ʼ�������������ֽ��Թ�B����Һ�ֳ����ݣ��ֱ�μ�һ��������ˮ�Ͱ�ˮ�������ְ�ɫ��������ѡ����һ��ʵ�飬������ӷ���ʽ���н�����_____________________________________________��
��2�����Ṥ���������к���SO2���ж��ַ�����ʵ����������
�� ���Ƽ����NaOH��Һ�����ռ����� 100 mL 0.3 mol��L-1��NaOH��Һ��ͨ���״����0.448 L SO2���壬������Һ�е�������_________________________________���ѧʽ����
�� ij���᳧���ú�Cr2O72�����Է�ˮ����������SO2����Ӧ��ĸ�Ԫ����Cr3+��ʽ���ڣ���Ӧ���������ͻ�ԭ�������ʵ���֮����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ͬ��pHҲ��ͬ��H2SO4��Һ��HCl��Һ���ֱ���NaOH��Һ�кͷ�Ӧʱ��������NaOH�����ʵ�����������
A. ��ͬ B. H2SO4��Һ���ĵ�NaOH��
C. HCl��Һ���ĵ�NaOH�� D. ���Ƚ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£������������Ϊ1.0 L�ĺ����ܱ������У���Ӧ2H2(g)+CO(g) ![]() CH3OH(g)�ﵽƽ�⡣����˵������ȷ����
CH3OH(g)�ﵽƽ�⡣����˵������ȷ����
���� | �¶�/K | ��ʼŨ��/(mol/L) | ƽ��Ũ��/(mol/L) | ||
H2 | CO | CH3OH | CH3OH | ||
�� | 400 | 0.20 | 0.10 | 0 | 0.08 |
�� | 400 | 0.40 | 0.20 | 0 | X |
�� | 500 | 0 | 0 | 0.10 | 0.025 |
A. X = 0.16 B. �÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ
C. ƽ��ʱ�ķ�Ӧ����:��>�� D. 400 K ʱ�÷�Ӧƽ�ⳣ����ֵΪ2500
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о����ܵ���ʵij����ܽ�ƽ�⼰������������Ӧ�������ش�
��1��FeS������ˮ�е�Hg2+�ķ�ӦʽΪ��_________________��
��2��������ͭ����Һ�д�������ƽ�⣺Cu(OH)2 (s)![]() Cu2+(aq)+2OH-(aq������������Ksp=c��Cu2+��c2��OH-��=2��10-20mol2L-2��
Cu2+(aq)+2OH-(aq������������Ksp=c��Cu2+��c2��OH-��=2��10-20mol2L-2��
��ij����ͭ��Һ��c(Cu2+)=0.02mol/L����Ҫ����Cu(OH)2������Ӧ������ҺpHʹ֮����_____��
��Ҫʹ0.2mol/L����ͭ��Һ��Cu2+������Ϊ��ȫ��ʹCu2+Ũ�Ƚ���ԭ����ǧ��֮һ������Ӧ����Һ���������������Һʹ��Һ��OH-Ũ��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������F��һ����Ҫ��ҽҩ�м��壬���Ʊ���������ͼ��ʾ��

��֪: ��
��
�ش���������:
(1)![]() ������Ϊ___________��������й���ԭ����Ŀ����Ϊ______________��
������Ϊ___________��������й���ԭ����Ŀ����Ϊ______________��
(2)![]() ֱ������Ҳ�����Ƶ�B������������ȴ���ɢ٢ڢ�������Ӧ��ȡB����Ŀ����__________________��
ֱ������Ҳ�����Ƶ�B������������ȴ���ɢ٢ڢ�������Ӧ��ȡB����Ŀ����__________________��
(3)��Ӧ����ҪĿ����______________�����������в�����ȡ����Ӧ����______(�����)��
(4)�л���C �к��������ŵ�����Ϊ__________��д����Ӧ��Ļ�ѧ����ʽ:____________________��
(5)��������������B ��ͬ���칹�干��______�֡�
a.������������ȡ���� b.���ܷ���������Ӧ���ܷ���ˮ�ⷴӦ
(6)��֪��������������ʱ�������������������Ҫ�������ļ�λ���Ա�Ϊ��Ҫԭ�ϣ�������ԭ����ѡ�����һ���ϳ�![]() �ĺϳ�·��:_______________________��ʾ��:A
�ĺϳ�·��:_______________________��ʾ��:A![]() B������Ŀ����
B������Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͨ���Ժ�ɫ�ķ�̪��Һ�У����ֺ�ɫ��ʧ����Ҫԭ����(����)
A.�����������Ư����B.����������л�ԭ��
C.�����������������D.������������ˮ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС���ij�ϾɺϽ𣨺���Cu��Fe��Si���ֳɷ֣����з��롢���ա��乤ҵ�������£�
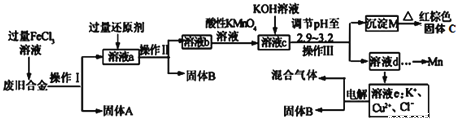
��֪��298Kʱ��Ksp[Cu(OH)2]=2.0��10-20��Ksp[Fe(OH)3]=4.0��10-38��Ksp[Mn(OH)2]=1.9��10-13��
�����������̻ش��й����⣺
��1����������������һ���������еIJ�����________��
A.����B.ϴ��C.����D.����
��2�������Ļ�ԭ��Ӧ��__________________����Һa�з����ķ�Ӧ�����ӷ���ʽΪ________________________________��
��3������xmol/LKMnO4��Һ������Һb����ǡ�ý���Һ�е���������ȫ����ʱ����KMnO4��ҺymL����������ú���ɫ����C������Ϊ________g(�ú�x��y�Ĵ���ʽ��ʾ)��
��4������Һc����pH��2.9-3.2��Ŀ����______________________________��
��5�������£�ȡ0.2mol/L��CuCl2��Һ����ҪʹCu2+��ʼ������Ӧ����pH��___________��
��6���ö��Ե缫�����Һe��ȡ����B���������Ļ�ѧ��Ӧ����ʽΪ___________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com