
����Ŀ����������±�����Ĵ�����ͨ�����������̽��������±���������ʣ����Դﵽ��һ������������ͨ��Ч����
I����֪��NaBr+H2SO4(Ũ) ![]() NaHSO4+ HBr CH3CH2OH+HBr
NaHSO4+ HBr CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
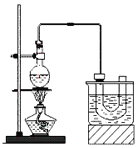
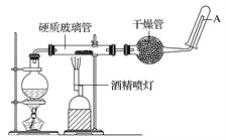
������ķе�38.4����ʵ�����Ʊ������飨CH3CH2Br����װ�úͲ������£�
�����װ�õ������ԣ���װ��ͼ��ʾ��U�ιܺʹ��ձ��м����ˮ��
����Բ����ƿ�м���10mL95%�Ҵ���28mL78%Ũ���ᣬȻ�������ϸ��13g�廯�ƺͼ������Ƭ��
��С�ļ��ȣ�ʹ���ַ�Ӧ��
�ش��������⣺
��1��Ϊ�˸��õĿ��Ʒ�Ӧ�¶ȣ�����ͼʾ��С����ȣ����õļ��ȷ�ʽ��_______________��
��2��Ũ�������ǿ�����ԣ���������ԭ������HBrΪBr2������U�ι��д��Ƶ���������ػ�ɫ��Ϊ�˳�ȥ�ֲ�Ʒ�е�����Br2����ѡ�������Լ��еģ�______������ţ�
A��NaOH��Һ B��H2O
C��Na2SO3��Һ D��CCl4
����ʱ�������Ҫ����������______________�����������ƣ���Ҫ��һ���Ƶô����������飬����ˮϴ��Ȼ�������ˮCaCl2���ٽ���_________����������ƣ���
II���������ڲ�ͬ�ܼ�����NaOH�ɷ�����ͬ���͵ķ�Ӧ�����ɲ�ͬ�ķ�Ӧ���ijͬѧ��������������ʣ���ͼʵ��װ��(����̨���ƾ�����)��֤ȡ����Ӧ����ȥ��Ӧ�IJ������һ�����̽����
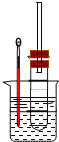
��1�����Թ��м���5 mL 1 mol/L NaOHˮ��Һ��5 mL �����飬���Թ���ͼ�̶����ȡ�
���Թܿڰ�װһ�����ܵ�������_____________________________��
���������������Ҵ��Ľṹ�����õIJ�����___________________��___________________��
��2�����Թ��м���5 mL NaOH�Ҵ���Һ��5 mL �����飬���Թ���ͼ�̶����ȡ�
����д���÷�Ӧ�Ļ�ѧ����ʽ____________________________________________________��
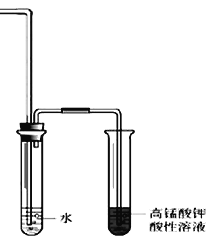
��Ϊ֤����������NaOH�Ҵ���Һ�з���������ȥ��Ӧ������Ƶ�ʵ�鷽���У���Ҫ�������___________�������װ����ͼ��ʾ��������ͨ�����Ը��������Һǰ��һ��ʢˮ���Թܣ���������_____________��
���𰸡�ˮԡ���� C ��Һ©�� ���� �������� ������� �˴Ź������� CH3CH2Br+NaOH![]() CH2=CH2����NaBr��H2O ��ϩ ��ȥ��ϩ�л��е��Ҵ�����
CH2=CH2����NaBr��H2O ��ϩ ��ȥ��ϩ�л��е��Ҵ�����
��������
I.��1��Ϊ�˸��õĿ����¶ȣ������ˮԡ���ȵķ�����
��2��U�ܵõ��������飬�������л����壬����ʱע���������������ʽǶȿ��ǣ���Һ�õ���Һ©���������鲻����ˮ��ˮϴ���Һ���룬�ټ�����ˮCaCl2�����������������
II.��1�����������ӷ����ó����ܽ������������������������ʧ��
�ڸ����Ҵ����ӽṹ����������ԭ��ѡ���ⷽ����
��2����������Ϊ±������ͬNaOH�Ҵ���Һ�ڼ��������»ᷢ����ȥ��Ӧ���䷴Ӧ����ʽΪ��CH3CH2Br+NaOH![]() CH2=CH2����NaBr��H2O��
CH2=CH2����NaBr��H2O��
�����۷���ȡ����Ӧ������ȥ��Ӧ����Һ�ж������Br-�������ɵ��л��ﲻͬ����Ӧ�������ɵ��л���Ҵ�������ˮ������ϩ������ˮ��
I.��1��Ϊ�˸��õĿ����¶ȣ�����ͼʾ��С������⣬�����ˮԡ���ȵķ�����
��2����U������Br2��A.�������ܹ����������Ʒ�Ӧ����A����B.��������嵥�ʾ�������ˮ�������з��룬��B����C.Na2SO3���巢��������ԭ��Ӧ��Na2SO3�ɳ�ȥ�壬��C��ȷ��D.��������鶼���������Ȼ�̼�����ܽ����߷��룬��D����������������Һϴ�Ӻ���Ȼ���Һ����ȡ��Һʹ�õ���Ҫ�����Ƿ�Һ©����Ҫ��һ���Ƶô�����C2H5Br������ˮϴ����Һ���ټ�����ˮCaCl2�����÷е㲻ͬ�ٽ���������룻
II.��1����������ķе�38.4�����������ӷ����ó����ܽ������������������������ʧ��
���Ҵ����ӽṹ����������ԭ�ӣ����ǵı�Ϊ3:2:1�����ú˴Ź������ɼ�⣬Ҳ���ú������⣻
��2����������Ϊ±������ͬNaOH�Ҵ���Һ�ڼ��������»ᷢ����ȥ��Ӧ���䷴Ӧ����ʽΪ��CH3CH2Br+NaOH![]() CH2=CH2����NaBr��H2O��
CH2=CH2����NaBr��H2O��
�����۷���ȡ����Ӧ������ȥ��Ӧ����Һ�ж������Br-�������ɵ��л��ﲻͬ�������鷢����ȥ��Ӧ������ϩ������Ӧ�������ɵ��л�����ϩ��������ϩ�ɸ�������ʹ���Ը��������ɫ��ԭ�����У���ͬʱ�Ҵ�Ҳ��ʹ���Ը��������ɫ������Ҫ��ȥ��ϩ�е��Ҵ����Ҵ�������ˮ������ϩ��������ˮ����������ͨ�����Ը��������Һǰ��һ��ʢˮ���Թܣ��������dz�ȥ��ϩ�л��е��Ҵ�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ���������ȷ����(����)
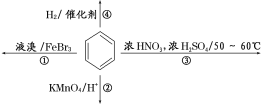
A. ��Ӧ�ٳ����²��ܽ���
B. ��Ӧ�ڲ��������������зֲ�������ɫ�����²�
C. ��Ӧ��Ϊȡ����Ӧ���л�������һ������������
D. ��Ӧ���ܷ������Ӷ�֤�������ǵ�˫������ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£�����ˮ������Ӧ�����ڸ����£�����ˮ�����ɷ�����Ӧ�� Ӧ������װ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ�����������ˮ�����ķ�Ӧʵ������
��ش��ʵ���е����⡣
��1��д���÷�Ӧ�ķ�Ӧ����ʽ��__________________________________����ָ����������ԭ��Ӧ�Ļ�ԭ����____________����������______________��
��2��ʵ��ǰ���������װ�ý��������Լ�飬����������_______________________________��
��3��Բ����ƿ��ʢװ��ˮ����װ�����Ⱥ����Ҫ������____________________________����ƿ�ײ������˼�Ƭ���Ƭ�����Ƭ��������__________________��
��4���ƾ��ƺ;ƾ���Ƶ�ȼ��˳����__________________________________��Ϊʲô��___________________________________________________________________��
��5���������ʢװ��������________________________��������_______________________��
��6���Թ����ռ���������__________�����Ҫ��A�������ܴ���ȼ�����壬�����Ը��������____________________��������________________________________����һ������Ŀ����________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ����ͼ��ʾ�������ܾ��е������ǣ� ��
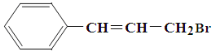
A. ��ʹ��ˮ��ɫ��������ʹ�������������Һ��ɫ
B. 1 mol ���л��������4 mol Br2�ӳ�
C. ��AgNO3��Һ��Ӧ��������ɫ����
D. ��NaOHˮ��Һ�м��ȿ��Է���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����Է�������Ϊ86�������ķ���ʽ�� _________��
��2����ϵͳ������������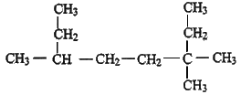 _______________________��
_______________________��
��3����ϵͳ������������ 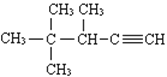 ______________________________��
______________________________��
��4��˳��2����ϩ�Ľṹ��ʽΪ_________________________��
��5��̼ԭ����1��10��������һ�ȴ���ֻ��һ�ֵ�������4�֣����ǵĽṹ��ʽΪCH4��CH3CH3��_____________________��_____________________��
��6��ʵ������ȡ��Ȳ�Ļ�ѧ����ʽΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС������������װ��̽��CO2��п�۷�Ӧ�Ƿ�����CO����֪CO�����Ȼ�����Һ������Ӧ���ɺ�ɫ�����٣�CO+PdCl2+H2O![]() CO2+Pd��+2HCl��ʵ��װ����ͼ��ʾ��
CO2+Pd��+2HCl��ʵ��װ����ͼ��ʾ��
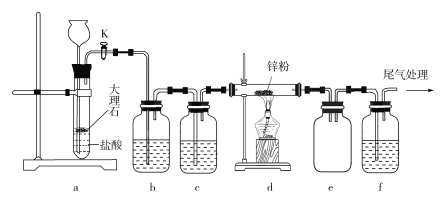
����������ȷ����
A. ʵ�鿪ʼʱ���ȼ���d���ƾ��ƣ��ٴ���K
B. װ��b��c�зֱ�װ�б���Na2CO3��Һ��Ũ����
C. �۲쵽װ��f����Һ��ڣ�˵����CO��������
D. װ��e�������Ƿ�������װ��f���ܿڴ���ȼ���Դ���β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҺX����K����Mg2����Fe3����Al3����Fe2����Cl����CO32����OH����SiO32����NO3����SO42���еļ��֣���֪����Һ�и��������ʵ���Ũ�Ⱦ�Ϊ0.20mol��L��1��������ˮ�ĵ��뼰���ӵ�ˮ�⣩��Ϊȷ������Һ�к��е����ӣ��ֽ��������µIJ�����
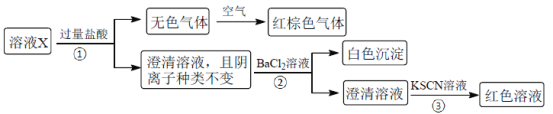
����˵����ȷ����
A.��ɫ���������NO��CO2�Ļ����
B.�ɲ���ۿ�֪��ԭ��Һ�϶�����Fe3��
C.��ҺX���������������4��
D.��ȡ100mLԭ��ҺX������������NaOH��Һ����ַ�Ӧ����ˣ�ϴ�ӣ����������أ������ϵõ��Ĺ�������Ϊ2.4g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ�У�ˮ��Ϊ����������
A. CO��H2O![]() CO2��H2 B. 3NO2��H2O��2HNO3��NO
CO2��H2 B. 3NO2��H2O��2HNO3��NO
C. 2Na2O2��2H2O��4NaOH��O2�� D. 2F2��2H2O��4HF��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯�ƣ�CaH2��������һ�ִ�����ϣ��ǵ�ɽ�˶�Ա���õ���Դ�ṩ����ij��ѧС���ͬѧ����ʦ��ָ�����Ʊ��⻯�ơ�
���������ϡ�
��������Ca�IJ���������
�� ���»����������Ca������������Ӧ����
�� Ca������ˮ�����������ҷ�Ӧ�����������ƺ����������ų��������ȣ�
�� Ca+H2![]() CaH2��������
CaH2��������
��������CaH2�IJ�����������
��������CaH2+2H2O��Ca(OH)2+2H2������CaH2Ҫ�ܷⱣ�档
������ʵ�顿
��С��ͬѧ��Ƶ���ȡװ����ͼ��ʾ���̶�װ���ԣ���

�ش��������⣺
��1��д��Ca������ˮ������Ӧ�Ļ�ѧ����ʽ�� ��
��2��B��D����ʢ�Լ���ͬ�����Լ�Ϊ �������ƣ���D�и��Լ��������� ��
��3��ʵ��ʱ�ȴ�A�л�����һ��ʱ����ٵ�ȼC�оƾ��ƣ���Ŀ���ǣ� ��
��ʵ�鷴˼��
��С��ͬѧͨ����˼������⣺�����Ƶõ�CaH2�Ƿ���
�����ٴ����ʵ����м��飬ʵ�鲽�����£�
����1�����װ�������ԣ�װ��������ˮ���ѳƺ�����Ϊm g��CaH2 ��Ʒ����ͼ��ʾ�����������̶�װ���ԣ���

����2����Y�ι���б��ʹA�е�ˮȫ������B�У���Ʒȫ����Ӧ����ȴ�����£���ȡ��Ͳ����ΪV mL��
��4������ʵ�������µ�����Ħ�����ΪVm L/mol����V= mLʱ����m��Vm��ʾ���������Ƶõ�CaH2��Ʒ�Ǵ����ġ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com