
【题目】某学习小组拟利用下列装置探究CO2和锌粉反应是否生成CO,已知CO能与氯化钯溶液发生反应生成黑色金属钯:CO+PdCl2+H2O![]() CO2+Pd↓+2HCl。实验装置如图所示:
CO2+Pd↓+2HCl。实验装置如图所示:
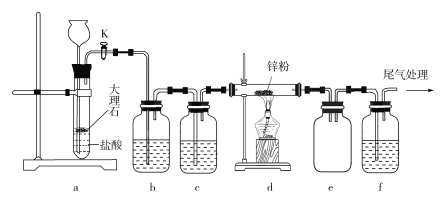
下列叙述正确的是
A. 实验开始时,先加热d处酒精灯,再打开活塞K
B. 装置b、c中分别装有饱和Na2CO3溶液和浓硫酸
C. 观察到装置f中溶液变黑,说明有CO气体生成
D. 装置e的作用是防倒吸,装置f导管口处点燃可以处理尾气
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
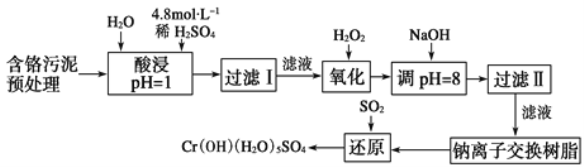
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1) 酸浸时,为了提高浸取率可采取的措施是____(至少写两条)。
(2)H2O2的作用是_____。
(3)调pH=8是为了除去___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)已知以下氧化还原反应方程式(未配平):Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4;以上反应各物质的配平系数依次为___。每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条退色,说明有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是卤代烃的代表,通过对溴乙烷的探究来掌握卤代烃的性质,可以达到举一反三、触类旁通的效果。
I.已知:NaBr+H2SO4(浓) ![]() NaHSO4+ HBr CH3CH2OH+HBr
NaHSO4+ HBr CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
溴乙烷的沸点38.4℃,实验室制备溴乙烷(CH3CH2Br)的装置和步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
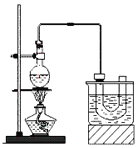
回答下列问题:
(1)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是_______________。
(2)浓硫酸具有强氧化性,能氧化还原性气体HBr为Br2,导致U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质Br2,可选择下列试剂中的:______(填序号)
A.NaOH溶液 B.H2O
C.Na2SO3溶液 D.CCl4
分离时所需的主要玻璃仪器是______________(填仪器名称)。要进一步制得纯净的溴乙烷,可用水洗,然后加入无水CaCl2,再进行_________(填操作名称)。
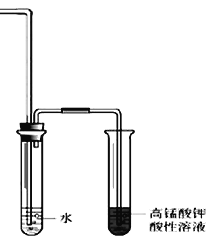
II.溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
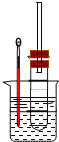
(1)在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL 溴乙烷,将试管如图固定后,加热。
①试管口安装一长导管的作用是_____________________________。
②鉴定生成物中乙醇的结构,可用的波谱是___________________和___________________。
(2)在试管中加入5 mL NaOH乙醇溶液和5 mL 溴乙烷,将试管如图固定后,加热。
①请写出该反应的化学方程式____________________________________________________。
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是___________,检验的装置如图所示,在气体通入酸性高锰酸钾溶液前加一个盛水的试管,其作用是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
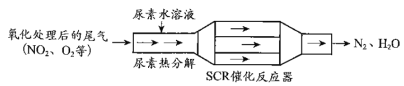
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:__________________
②反应器中NH3还原NO2的化学方程式:________________________;
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:_____________________________;
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________________;
(2)NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。
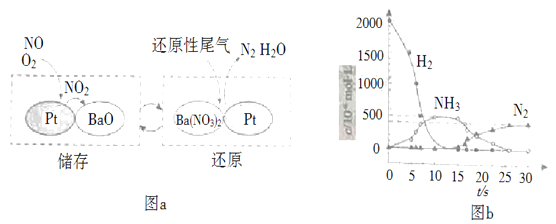
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。还原NOx的物质是_________________;
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与Ba(NO3)2的物质的量之比是__________________;
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:__________________![]() ____15NNO+___H2O
____15NNO+___H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关表述正确的是 ( )
A. 醋酸的电离方程式:CH3COOH=CH3COO-+H+
B. Na与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑
C. NaHCO3的电离方程式:NaHCO3=Na++H++CO32-
D. Cu溶于稀HNO3的离子方程式:Cu+2H+=Cu2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 铁与稀盐酸反应: | 正确 |
B | 大理石溶于醋酸的反应: | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | 向Ba(OH)2溶液中滴加少量NaHCO3溶液:Ba2++ OH-+HCO3- = BaCO3↓+ H2O | 错误,方程式中Ba2+和OH-化学计量数之比为1∶2 |
D | NH4HCO3溶液与过量KOH浓溶液共热: | 错误,HCO3-也可以与OH-反应 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com