

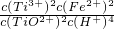 ,故答案为:
,故答案为: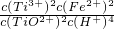 ;
;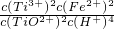 ;
;

科目:高中化学 来源: 题型:
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源:2012届甘肃省兰州一中高三上学期期末考试理综试卷(化学部分) 题型:实验题
(15分)某校兴趣小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南京学大教育专修学校高一4月月考化学试卷(带解析) 题型:实验题
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |

查看答案和解析>>
科目:高中化学 来源:2011-2012学年武汉二中高二上学期期中考试化学试卷 题型:实验题
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示的3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
查看答案和解析>>
科目:高中化学 来源:2013届武汉二中高二上学期期中考试化学试卷 题型:实验题
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示的3组,第2组中物质X的化学式是 。
|
第1组 |
第2组 |
第3组 |
|
S(单质) |
SO2、X、Na2SO3、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
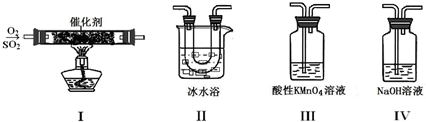
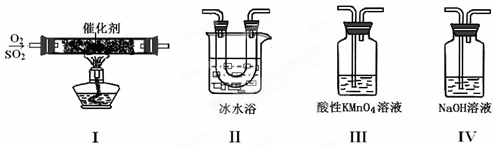
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO3 45℃)
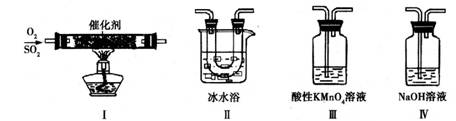
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;
装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是
。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有70mL 2mol·L-1NaOH溶液,反应后增重5.12g,则装置Ⅳ中发生反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com