
| A. | 1.12L | B. | 2.24L | C. | 4.48L | D. | 6.72L |
分析 400mL2.5mol/L的硫酸亚铁中,n(Fe2+)=0.4L×2.5mol/L=1mol,通入氯气发生反应2Fe2++Cl2═2Fe3++2Cl-,充分反应后,溶液中的Fe3+与Fe2+的物质的量浓度之比为2:3,则n(Fe3+)=1mol×$\frac{2}{5}$=0.4mol,结合反应方程式计算氯气.
解答 解:400mL2.5mol/L的硫酸亚铁中,n(Fe2+)=0.4L×2.5mol/L=1mol,通入氯气发生反应2Fe2++Cl2═2Fe3++2Cl-,充分反应后,溶液中的Fe3+与Fe2+的物质的量浓度之比为2:3,则n(Fe3+)=1mol×$\frac{2}{5}$=0.4mol,反应消耗的氯气的物质的量为:n(Cl2)=$\frac{1}{2}$n(Fe3+)=0.2mol,所以V(Cl2)=0.2mol×22.4L/mol=4.48L;
故选C.
点评 本题考查有关离子方程式的计算,难度不大,明确溶液中发生的反应以及反应各物质之间的关系是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | NA个N2分子和NA个CO分子质量比为1:1 | |
| B. | 1 mol H2O的质量等于6.02×1023个H2O质量的总和 | |
| C. | 在任何条件下1mol H2所含的原子数为NA | |
| D. | 1mol H2SO4中所含的粒子数目一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将322 gNa2SO4•10H2O溶于1L水中,所得溶液的物质的量浓度为1 mol•L-1 | |
| B. | 将1L2mol•L-1 H2SO4溶液加水稀释到2L,所得溶液的物质的量浓度为1mol•L-1 | |
| C. | 将1L18.4 mol•L-1的H2SO4溶液加入到1L水中,所得溶液的物质的量浓度为9.2mol•L-1 | |
| D. | 将336mLHCl气体溶于水,配成300mL溶液,所得溶液的物质的量浓度为0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1 Na2CO3溶液中:c(HCO3-)=2c(H2CO3)+c(H+)-c(OH-) | |
| B. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO3) | |
| C. | 同浓度的下列溶液中,①NH4HSO4②NH4Cl ③NH3•H2O,c(NH4+)由大到小的顺序是:②>①>③ | |
| D. | 常温下,pH=3的 CH3COOH溶液和pH=11的NaOH溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打电离方程式:NaHCO3+H2O?Na++H3O++CO32- | |
| B. | 丙烷分子的球棍模型: | |
| C. | 氮气化学性质稳定是因为其分子中含有氮氮三键,电子式为 | |
| D. | 核内含有1个质子和1个中子的原子可表示为:${\;}_{1}^{1}$H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  |  |
| A、向一定量稀盐酸中加水稀释 | B、一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 | C、加热一定量的高锰酸钾固体 | D、向盐酸和氯化镁的混合溶液中滴加氢氧化钾溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装Al2(SO4)3 溶液的烧杯是原电池,其余两个为电解(电镀)池 | |
| B. | 盐桥中电子从右侧流向左侧 | |
| C. | 电极Ⅱ逐渐溶解 | |
| D. | 电极IV的电极反应:Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
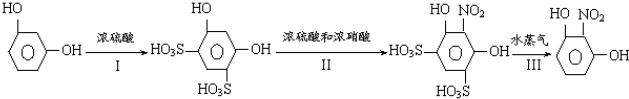

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com